§ 14. Строение электронных оболочек атомов и структура Периодической системы
Вспомните: структуру Периодической системы (§ 7).
Число химических элементов в периодах
Структура Периодической системы полностью определяется принципами строения электронной оболочки атомов. Это еще раз подтверждает гениальность Д. И. Менделеева, который создал Периодическую систему, не имея представления об электронах и сложном строении электронной оболочки.
Число химических элементов, находящихся в каждом периоде, определяется вместимостью соответствующих энергетических уровней и подуровней. Учитывая заполняемость энергетических подуровней химических элементов, можно определить число химических элементов в периоде:
|
Период |
Подуровни, заполняемые электронами в атомах элементов этого периода |
Максимальное число электронов на подуровнях |
Число химических элементов в периоде |
|
1 |
1s (1 орбиталь) |
2 |
Два: 1 (H) — 2 (He) |
|
2 |
2s 2p (4 орбитали) |
8 |
Восемь: 3 (Li) — 10 (Ne) |
|
3 |
3s 3p (4 орбитали) |
8 |
Восемь: 11 (Na) — 18 (Ar) |
|
4 |
4s 3d 4p (9 орбиталей) |
18 |
Восемнадцать: 19(K) — 36 (Kr) |
Классификация химических элементов
Вы уже знаете, что атомные орбитали разделяют по типам на s, p, d и f. Так же классифицируют и химические элементы.
Если в атомах химического элемента последним заполняется s-подуровень, то такие элементы относят к s-элементам. В Периодической системе клетки с такими элементами обычно окрашены в красный цвет (см. форзац 1). Если последним заполняется p-подуровень, то такие элементы называют ^-элементами (желтый цвет). Соответственно, d-подуровень заполняется у d-элементов (синий цвет) и f-подуровень — у f-элементов (зеленый цвет).
Вы уже заметили, что на каждом энергетическом уровне есть s-подуровень, который максимально содержит два электрона и всегда заполняется первым. Это обусловливает то, что каждый период Периодической системы всегда начинается с двух s-элементов.
Начиная со второго энергетического уровня появляется р-под-уровень, который максимально содержит шесть электронов. Следовательно, в каждом периоде, начиная со второго, содержится по шесть р-элементов. Соответственно, каждый период, начиная с четвертого, содержит по десять d-элементов, а начиная с шестого — еще по четырнадцать f-элементов, которые образуют два семейства элементов — лантаноиды и актиноиды.
Строение электронных оболочек и группы Периодической системы
Рассмотрим строение электронных оболочек атомов таких химических элементов: Литий, Натрий, Оксиген и Сульфур. Если их сравнить, то можно увидеть, что у элементов одной группы подобная электронная формула атомов.
В атомах Лития и Натрия, расположенных в I группе Периодической системы, на внешнем уровне находится по одному электрону на s-орбиталях. Отличие лишь в том, что у Лития внешним является второй энергетический уровень, а у Натрия — третий. Так же у атомов Оксигена и Сульфура. Эти элементы относятся к VI группе, значит, на внешних уровнях их атомов — по шесть электронов, которые у них одинаково распределены по s- и ^-подуровням. Таким образом, эти две пары элементов являются электронными аналогами.
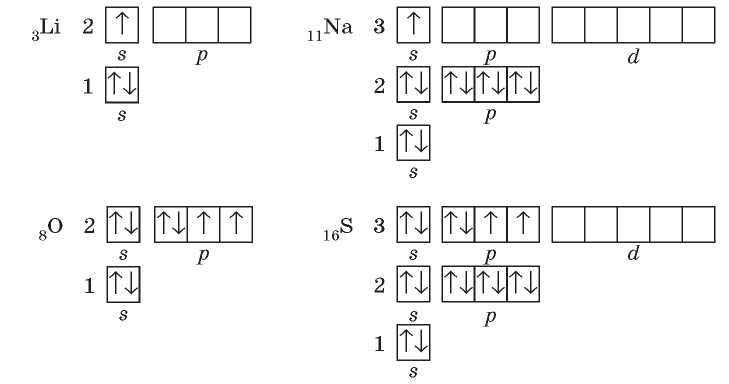
Когда вы ознакомились с общим строением Периодической системы, то узнали, что в группы объединены элементы со сходными свойствами. Основываясь на электронном строении атомов, можно утверждать, что это сходство прежде всего определено электронной аналогией.
Строение внешнего электронного уровня атомов химических элементов, относящихся к одной подгруппе, является подобным (рис. 14.1).
Распределение элементов по главным и побочным подгруппам также определяется строением электронных оболочек атомов. К главным подгруппам относятся только s- и ^-элементы, у которых заполняется внешний энергетический уровень, а к побочным
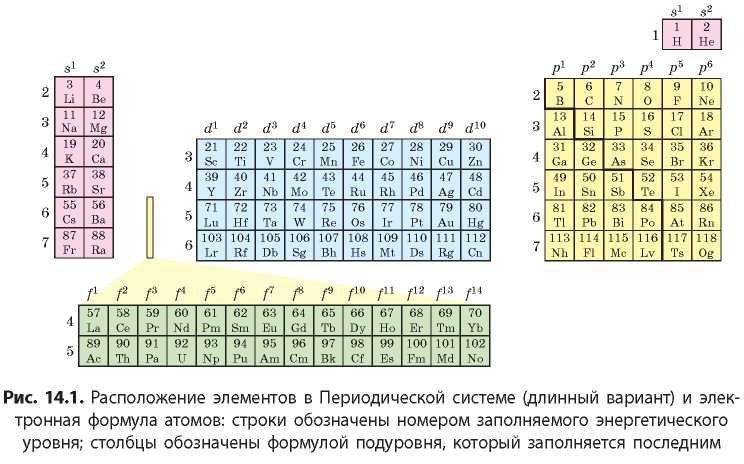
подгруппам относятся только d-элементы, у которых заполняется предпоследний электронный слой. Таким образом, принцип заполнения электронных оболочек атомов электронами полностью отражен в структуре Периодической системы.
Выводы
1. Число химических элементов в каждом периоде определяется исключительно строением электронной оболочки атомов. Первый период может содержать только два элемента, второй и третий — по восемь и т. д.
2. По строению электронных оболочек химические элементы делят на s-, p-, d- и /-элементы. Каждый период начинается двумя s-элементами и заканчивается шестью p-элементами. В каждом периоде, начиная с четвертого, между s- и p-элементами расположено по 10 d-элементов. А /-элементы образуют два семейства элементов — актиноиды и лантаноиды.
3. Распределение элементов по группам также основано на строении электронной оболочки атомов. Элементы одной подгруппы (главной или побочной) являются электронными аналогами: строение внешнего электронного уровня у этих элементов сходно.
Контрольные вопросы
1. Почему первый период содержит только два химических элемента, а второй — восемь? Чем обусловлена «вместимость» периодов?
2. Число энергетических уровней, которые заполняются электронами, определяют: а) по номеру периода; б) номеру группы; в) порядковому номеру элемента.
3. Число электронов на внешнем энергетическом уровне определяют: а) по номеру периода; б) номеру группы; в) порядковому номеру.
4. Как определить максимальное число электронов, которое может находиться на энергетическом уровне?
5. Сколько элементов относится к четвертому и шестому периодам? Сколько электронов может находиться на четвертом энергетическом уровне?
6. Объясните, почему Натрий и Калий являются электронными аналогами.
7. По какому принципу элементы делят на s-, р-, d- и /-элементы? Приведите примеры d-элементов пятого периода и /-элементов седьмого периода.
8. Сколько s- и р-элементов может находиться в одном периоде? Почему?
9. Как называют семейства химических элементов, в атомах которых последним заполняется /-подуровень?
Задания для усвоения материала
1. Какой уровень состоит только: а) из s-подуровня; б) s- и р-подуровней; в) s-, р- и (/-подуровней? Как вы это определили?
2. Какие химические элементы являются электронными аналогами Нитрогена? Изобразите электронную формулу атома одного из них.
3. В чем заключается принципиальное отличие в строении электронной оболочки атомов главных и побочных подгрупп?
4. Какой энергетический подуровень заполняется последним: а) у s-элементов четвертого периода; б) р-элементов пятого периода; в) s-элементов третьего периода; г) р-элементов второго периода?
5. Назовите два элемента, в атомах которых число пар электронов равно числу неспаренных электронов.
6. Запишите электронные формулы атомов элементов с порядковыми номерами 11 и 14.
7. Назовите металлический и неметаллический элементы второго периода, которые на внешнем уровне имеют один неспаренный электрон.
8. Какой энергетический уровень заполняется электронами в атомах элементов № 3, 9, 16?
9. Составьте графическую электронную формулу атома элемента с порядковым номером 15. Составьте формулы его высшего оксида и гидратов этого оксида. Укажите химический характер оксида и гидратов.
10. Какой элемент второго периода является электронным аналогом элемента с порядковым номером 12?
11. Составьте графическую электронную формулу атомов Si, B и Аг.
12. Атомы каких элементов имеют следующее строение внешнего электронного слоя: а) 3s23p1; б) 3s23p3; в) 3s1; г) 4s2?
13. Сколько электронов находится на внешнем электронном уровне в атомах: а) Арсена; б) Станума; в) Бария?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:30, Переглядів: 3276