§ 13. Тепловий баланс. Рівняння теплового балансу
Думки вголос
Я вчуся розв’язувати задачі, які характеризують теплообмінні процеси, використовуючи рівняння теплового балансу.
На початку розділу вже відзначалося, шо за результатами багатьох експериментальних досліджень було сформульовано фізичний закон збереження енергії, справедливий і для теплових явищ:
Енергія у природі не виникає з нічого і не зникає. Вона лише переходить з одного виду в інший або переходить від одного тіла до іншого.
На практиці доволі часто виникає потреба розв’язати задачі, які характеризують теплообмінні процеси, що протікають за умови встановлення теплового балансу, який є наслідком закону збереження енергії.
Наведемо кілька прикладів таких процесів.
• Під час змішування гарячої і холодної води іноді треба узнати температуру суміші.
• У разі контакту тіл з різною температурою потрібно знати, яку кількість теплоти віддають одні тіла і поглинають інші.
• Часто виникає завдання підрахувати кількість теплоти, яку треба надати одним тілам або забрати в інших тіл, щоб досягти заданої температури.
Під час вирішення таких проблем треба складати і розв’язувати рівняння, в яких невідомими величинами будуть згадані величини із наведених вище прикладів процесів. Такі рівняння називають рівняннями теплового балансу. Складати ці рівняння зовсім неважко, якщо вивчити і запам’ятати такі правила:
• усі тіла, що беруть участь у теплообміні, з часом переходять у стан теплової рівноваги, який характеризується встановленням у них однакової температури;
• згідно із законом збереження і перетворення енергії (загальний закон природи) теплота не може зникнути безслідно або з’явитися з нічого. Тому під час теплообміну кількість теплоти Q8lfl, яку віддають одні тіла, дорівнює кількості теплоти Qup, яку приймають інші тіла. Математично цю умову записують у вигляді рівняння теплового балансу:
QbIm — Qup
Число тіл, які беруть участь в теплообміні, а також процеси теплообміну в конкретних задачах можуть бути різними, тому обидві частини рівняння теплового балансу можуть складатися із суми формул, що відповідають різним процесам. Розглянемо це на прикладі.
Приклад розв’язування задач. В алюмінієвій каструлі масою 1,5 кг міститься 800 г води кімнатної температури (20 °С). Скільки кип’ятку потрібно долити в каструлю, щоб одержати воду з температурою 45 °С?

Записуємо формулу кількості теплоти для всіх цих процесів. При цьому завжди від більшого значення температури віднімаємо менше:
Q1 = C1 · /п^з - і) — кількість теплоти, що віддає кип’яток.
Q2= C1- m2(t ~t2) — кількість теплоти, що одержує холодна вода.
Q3= C1- ms(t - t2) — кількість теплоти, що одержує каструля.
Крок 4. Складаємо рівняння теплового балансу:
Qi = Q-2 + Qs-
Підставляючи в рівняння всі формули, одержуємо розширене рівняння теплового балансу:
C1- m1(t1 - t) = C1- m2(t -t2) + с2- ms(t - ts).
Крок 5. Розв’язуємо рівняння теплового балансу відносно невідомої величини Zn1.
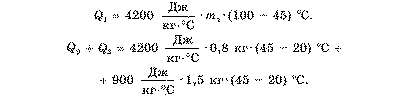
Підставивши ці вирази у рівняння теплового балансу, отримаємо значення Tn1 = 0,5 кг.
Відповідь: в каструлю треба влити 0,5 кг кип’ятку для досягнення температури води 45 °С.
Підсумки
• Потрібно вивчити алгоритм розв’язання задач на тепловий баланс.
• Знати рівняння теплового балансу:
Qeirt - Qup*
Перевір свої знання
1**.У мідний котел масою 20 кг налито 50 л води температурою 10 cC. Яку кількість теплоти потрібно віддати котлу з водою, щоб вона закипіла?
2**. Змішали 0,8 кг води температурою 35 cC і 0,3 кг кип’ятку. Яка температура суміші? Яку кількість теплоти віддав кип’яток? Яку кількість теплоти отримала вода?
З**. У калориметр, в якому було 1 л води температурою 20 °С, налили воду температурою 100 °С. Через деякий час у калориметрі встановилася температура ЗО °С. Скільки гарячої води долили в калориметр?
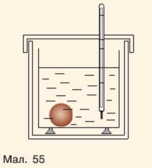
4***. У калориметр (мал. 55), в якому знаходиться 200 г води за ΐ = 10 °С, поклали мідне тіло масою 50 г температурою ΐ = 100 °С. Визнач, яка температура встановилася в калориметрі.
5***. Для приготування ванни треба змішати холодну воду за температури 11 0C і гарячу за температури 66 °С. Яку кількість холодної і гарячої води потрібно взяти для одержання 110 л води за температури 36 °С?
6***, В калориметр вливають ложку теплої води. При цьому його температура збільшилась на 5 °С. Після влиття ще однієї ложки теплої води температура збільшилась ще на З °С. На скільки збільшиться температура в калориметрі (порівняно з початковою), якщо в нього влити ще три ложки теплої води? Скільки ложок води було спочатку в калориметрі? Теплообмін з навколишнім середовищем не враховувати.
ЛАБОРАТОРНА РОБОТА № 2
ПОРІВНЯННЯ КІЛЬКОСТІ ТЕПЛОТИ
ПІД ЧАС ЗМІШУВАННЯ ВОДИ РІЗНОЇ ТЕМПЕРАТУРИ
Мета. Дослідним шляхом переконатися, чи справджується рівняння теплового балансу під час змішування води різної температури.
Обладнання: калориметр, термометр, мірний циліндр чи мензурка, склянка, посудини з водою.
Теоретичні відомості
Як відомо, рівняння теплового балансу передбачає врахування у теплообмінному процесі всіх тіл, що взаємодіють. Проте на практиці це вдається зробити не завжди, оскільки можливі втрати теплоти в навколишнє середовище або інші процеси, тепловий ефект яких важко врахувати. Через це, досліджуючи теплообмінні процеси, зокрема, під час змішування води різної температури, важливо якомога зменшити такі втрати теплоти, тоді й результат буде надійнішим, і дослід більш досконалим.
Для цього найчастіше використовують калориметр, у якого подвійні стінки з повітряним прошарком, його теплопровідність мала порівняно з іншими тілами. Це зменшує обмін теплотою між калориметром і навколишнім середовищем, що дає змогу спростити рівняння, оскільки можна знехтувати одним із доданків. Крім того, виконувати дослід треба чітко, не гаючи часу на підготовчу роботу. Головне — це зафіксувати стан теплової рівноваги, про що свідчать сталі показання термометра.
Оскільки в шкільних умовах важко забезпечити високу точність вимірювань калориметричним методом, обчислення краще робити з двома значущими цифрами.
Виконання роботи
1. За допомогою мірного циліндра чи мензурки відміряйте в склянку приблизно 100 мл холодної води і виміряйте її температуру (бажано мати воду кімнатної температури).
2. Налийте в калориметр приблизно таку саму кількість гарячої води і виміряйте її температуру.
3. Обережно влийте зі склянки в калориметр холодну воду і після встановлення теплової рівноваги виміряйте температуру суміші.
4. Результати вимірювань запишіть у таблицю.
|
Маса холодної води тл, г |
Початкова температура холодної води *1, °С |
Маса гарячої води т2, г |
Початкова температура гарячої води f2, °С |
Температура суміші f, °С |
δ. Обчисліть кількість теплоти Q1, яку отримала холодна вода:
Q1 = cmx(t - U).
6. Обчисліть кількість теплоти Q2, яку віддала гаряча вода:
Q2 — cm2(t2 ~ ί).
7. Порівняйте одержані значення і зробіть висновок.
Дайте відповіді на запитання
1. Яка роль повітряного прошарку в будові калориметра в цій лабораторній роботі?
2. Чому бажано холодну воду мати кімнатної температури?
3. Оцініть витрати теплової енергії на нагрівання навколишнього середовища в цій роботі. Поясніть результат.
Додаткові завдання
Розв’яжіть задачі
1. В калориметр налили 0,5 кг води при 20 °С. Скільки кип’ятка треба долити в калориметр, щоб в ньому встановилася температура 80 °С?
2. У порожній стальний чайник масою 400 г, температура якого 20 °С, налили 100 г окропу. Яка температура встановиться в чайнику?
3. Скільки треба змішати холодної води J1 = 10 °С і гарячої t2 = 90 0C води, щоб отримати т = 60 кг води з температурою t = 50 °С?
ВИСНОВКИ ДО РОЗДІЛУ І Конспект теоретичного матеріалу
• Теплові явища в природі пояснюються внутрішньою будовою речовин і змінами в тепловому русі хаотичного руху мікрочастинок речовини. Енергію руху і взаємодії частинок, із якої складається тіло, називають внутрішньою енергією.
• Внутрішня енергія може передаватися від більш нагрітого тіла до менш нагрітого до встановлення теплової рівноваги. Стан теплової рівноваги тіл характеризується температурою. Температура (f) — фізична величина.
• Температура — фізична величина, яка є мірою середньої кінетичної енергії хаотичного руху молекул і атомів даного тіла та характеризує інтенсивність їх теплового руху.
• У стані теплової рівноваги у всіх тіл системи температура однакова.
• Термометри — прилади, що вимірюють температуру тіл, які знаходяться в стані теплової рівноваги. Для вимірювання температури існують різні шкали, найбільш поширена шкала Цельсія. У цій шкалі визначено дві реперні точки: за 0 °С прийнято температуру танення льоду або замерзання води, за 100 0C — температуру кипіння води при нормальному тиску.
• Речовина може перебувати в трьох агрегатних станах: твердому, рідкому, газовому. Речовина в кожному агрегатному стані має фізичні властивості, які пояснюють внутрішньою будовою речовини.
• Тверді тіла, рідини і гази під час нагрівання розширюються і скорочуються під час охолодження.
• Внутрішню енергію тіла можна змінити двома способами: виконанням роботи і теплопередачею. Якщо механічну роботу виконує саме тіло, то його внутрішня енергія зменшується, а якщо зовнішні сили виконують роботу над тілом — його внутрішня енергія збільшується. Теплопередача може здійснюватися трьома шляхами: теплопровідністю, конвекцією, випромінюванням.
• Теплопровідність — перенос енергії від більш нагрітих ділянок тіла до менш нагрітих в результаті руху і взаємодії мікрочастинок тіла. Під час теплопровідності речовина не переноситься.
• Конвекція — перенесення енергії струменями газу або рідини. Конвекція буває природна і вимушена.
• Випромінювання — вид передачі енергії тепловим промінням. Будь-яке тіло за температури, більшої від абсолютного нуля, випускає теплове проміння, це випромінювання то сильніше, що вища температура тіла.
• Зміну внутрішньої енергії можна обчислити, знаючи, від чого ця зміна залежить. Кількість теплоти O — це величина, на яку змінюється внутрішня енергія тіла під час теплопередачі. Одиниця кількості теплоти — 1 Дж.
• Питома теплоємність речовини — фізична величина, яка показує кількість теплоти, яку потрібно надати речовині масою 1 кг для зміни її температури на 1 °С (за нагрівання або охолодження тіла).
• O = cm At— формула для розрахунку кількості теплоти, що потрібна для нагрівання або охолодження тіла масою тна зміну температури At.
Дай відповіді па запитаная.
1. Чому ріки і озера нагріваються сонячним промінням повільніше, ніж суша?
2. Чому залізні печі швидше нагрівають приміщення, ніж цегляні, але не так довго залишаються теплими?
3. Чому брудний сніг весною розтає швидше, ніж чистий?
Вибери правильну відповідь.
1. Який вид теплопередачі не супроводжується переносом речовини?
• Тільки випромінювання. · Випромінювання і тепло-
• Тільки теплопровідність. провідність.
• Випромінювання і конвекція.
2. Яким способом передається енергія від Сонця до Землі?
• Тільки випромінюванням. · Випромінюванням і тепло-
• Тільки конвекцією. провідністю.
• Тільки теплопровідністю.
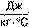
Що це значить?
3. Питома теплоємність міді дорівнює 400
Для нагрівання 400 кг міді на 1 °С треба витратити кількість теплоти 1 Дж.
Для нагрівання 1 кг міді на 1 °С треба витратити кількість теплоти 400 Дж.
Для нагрівання 1 кг міді на 400 0C треба витратити кількість теплоти 1 Дж.
Для нагрівання 400 кг міді на 1 °С треба витратити кількість теплоти 400 Дж.
4. Яка кількість теплоти виділяється при остиганні шматка сталі масою
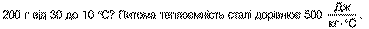
200 Дж.
200 кДж.
• 2 кДж.
20 кДж.
•••о
Розв’язування задач
1**. Яку кількість теплоти необхідно передати латунній деталі масою 500 г, щоб нагріти її від 20 до 120 °С? Питома теплоємність Дж
латуні 400 —— .
КГ · O
2**. У стальній каструлі масою 0,4 кг нагрівають 3 л води від 10 °С до кипіння. Яку кількість теплоти треба передати каструлі з водою? (Значення питомої теплоємності сталі і води візьми із таблиці 8 у підручнику.)
З***. У мідному казанку масою 200 г знаходиться 1,5 л води за температури 20 °С. До якої температури нагріється казан з водою, якщо йому передали кількість теплоти 447 кДж? (Значення питомої теплоємності міді і води візьми із таблиці 8 у підручнику.)
Орієнтовні теми навчальних проектів до розділу 1
1. Унікальні властивості води
2. Енергозбережувальні технології
3. Екологічні проблеми теплоенергетики та теплокористування
Розділ
Зміна агрегатних станів речовини
ЧАСТИНА І. ТЕПЛОВІ ЯВИЩА
Кристалічні та аморфні тіла. Плавлення і тверднення кристалічних тіл, графіки цих процесів
Питома теплота плавлення і тверднення. Розрахунок кількості теплоти, що потрібна для плавлення тіла та виділяється ним під час його тверднення
Енергія палива. Питома теплота згоряння палива. Обчислення кількості теплоти, що виділяється за повного згоряння палива
Пароутворення і конденсація. Кипіння рідини. Температура кипіння Питома теплота пароутворення і конденсації. Розрахзпнок кількості теплоти, що потрібна для пароутворення та виділяється під час конденсації Робота газ}' й пари за їхнього розширення Принцип дії теплових двигунів. ККД теплового двигуна. Двигун внутрішнього згоряння Наноматеріали
Це матеріал з Підручника Фізика 8 Клас Сердюченко
Автор: evg от 11-08-2016, 15:03, Переглядів: 17146