Будова атома
Що спільного в будові атома та Сонячної системи?
Історія відкриття будови атома
Д. І. Менделєєв писав: «Легко припустити, але нині поки немає ще можливості довести, що атоми простих тіл, які є у складних тілах, утворені з деяких ще мениіих частинок, що називаються неподільними (іатоми) — неподільні тільки звичайними хімічними силами, як частинки неподільні у звичайних умовах фізичними силами. Періодична залежність між властивостями і вагою, мабуть, підтверджує таке передчуття...»
Це спонукало вчених на активніші пошуки та експерименти і на початку XX століття фізики змогли розділити атом на ще менші частинки.
Перші моделі будови атома з’являються на початку XX століття. Жан Перрен 1901 року зробив припущення, що атом має ядерно-планетарний устрій.
іміркуйте! З яких частинок складається атом? шу планетарна модель атома, яку запропонував Жан Перрен, іримала таку назву?
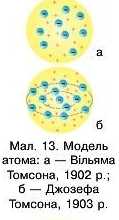
У 1902 році BLibHM Томсон (лорд Кельвін) вважав, що атом схожий на булочку з родзинками чи кекс (мал. 13, а). Згодом більш досконалу модель запроно-нував Джозеф Джон Томсон. Суть його ідеї полягала в тому, що електрони всередині позитивно зарядженої кулі розташовані в одній площині й утворюють концентричні кільця (мал. 13, б).
Проте всі згадані моделі не були підтверджені експериментально.
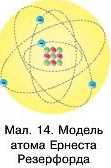
Ернест Резерфорд 1911 року запропонував свою модель атома — ядерну: у центрі атома розташоване позитивно заряджене ядро, розмір якого дуже малий порівняно з розмірами самого атома. Навколо ядра обертаються електрони. Його модель найбільше нагадує Сонячну систему: Сонце, так би мовити, — це ядро, а планети нодібні до електронів (мал. 14). Тому модель Резерфорда ще називають планетарною. Якщо ядро збільшити до розмірів футбольного м’яча, то розмір усього атома буде завбЬіьшки з нашу планету.
Склад атомних 5ідер
Атом елекронейтральний. Позитивний заряд ядра компенсується сумарним негативним зарядом електронів.
Поміркуйте! Попрацюйте в парах. Доведіть за допомогою математичних обчислень електронейтральність атома Оксигену.
Гіпотезу про прогонно-нейтронну будову атомного ядра першим висунув 1932 року український вчений Д. Д. Іваненко.
Протон — з грец. — перший.
Нейтрон — від лат. — ні те, ні інше.
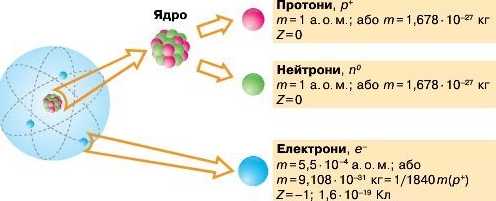
Ядро складається з частинок: позитивно заряджених протонів, р* і нейтральних — нейтронів п°, які дуже пцльно між собою зв’язані.
Маси протонів і нейтронів приблизно однакові й дорівнюють І а. о..«.
Нуклонний — від лат. nuclear — ядро.
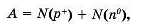
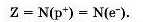
Нуклонне і протонне числа
Уся маса атома зосереджується у ядрі і дорівнює сумі мас ядерних частинок. Маса електрона майже у 2000 разів менша за маси ыротона та нейтрона, тому вважа-
ють, що маса електрона близька до нуля.
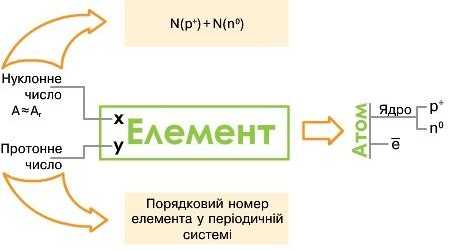
Суму нротонів і нейтронів називають ну-клонним числом і позначають А. Нуклонне число є цілим числом і визначається за формулою:

Кількість нротонів для атомів невного хімічного елемента унікальна і називається цротонним числом.
Виходячи з цього твердження можна перефразувати визначення хімічного елемента:
Хімічний елемент — це вид атомів з певним протонним числом.
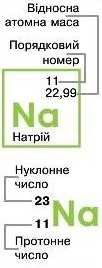
Схарактеризуємо будову атома Натрію.
Порядковий номер цього елемента 11, отже: заряд ядра атома Z(Na) = +11, кількість протонів N(p*) =11 кількість нейтронів Ν(η°) = 23-11 = 12. кількість електронів N(e") = 11
Підготуйте виступ «Будова атома», скориставшись схемою.
1. Назвіть перші моделі будови атома та вкажіть їхні недоліки.
2. Перелічіть та охарактеризуйте частинки, що утворюють ядро атомів.
3. Яких частинок у кожному атомі завжди однакова кількість? Чому?
4. Визначте заряд ядра атома та сам елемент, якщо до складу його атома входить 8 протонів та 8 нейтронів.
5. Складіть формулу для визначення кількості нейтронів.
6. Підготуйте в зошиті таблицю за зразком і заповніть її відповідно до наведених даних.
|
Елемент |
Заряд ядра, Z |
Нуклонне число, А |
Кількість протонів, N(p') |
Кількість нейтронів, N(n°) |
Кількість електронів, N(e) |
|
Al |
|||||
|
+7 |
|||||
|
19 |
|||||
|
26 |
|||||
|
19 |
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:34, Переглядів: 1825