Електронна природа хімічного зв'язку. Поняття про електронегативність елементів. Ковалентний зв'язок
Хімічний зв’язок - центральна, найголовніша проблема хімії. Тому деякі хіміки справедливо вважають, що розкрити природу, характер хімічного зв’язку, закономірності утворення й руйнування його - означає розкрити механізм і сутність процесу перетворення речовин, тобто саму суть хімічного руху.
М.А. Будрейко
Після опрацювання параграфа ви зможете:
• наводити прикладисполук із ковалентним (полярним і неполярним) хімічним зв'язком;
• пояснюватиутворення ковалентного (полярного і неполярного) зв'язків;
• обґрунтовуватиприроду хімічних зв'язків;
• характеризуватиособливості ковалентного зв'язку;
• використовуватипоняття електронегативності для характеристики хімічних зв'язків.
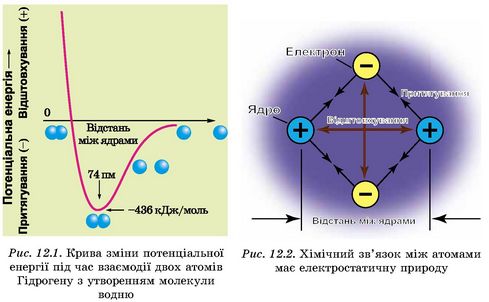
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Для утворення хімічного зв’язку між двома атомами необхідно, щоб енергія системи з двох атомів була нижчою за енергію окремо взятих атомів (рис. 12.1).
Розглянемо утворення хімічного зв’язку в молекулі водню. Спочатку два атоми Гідрогену перебувають далеко один від одного й не справляють взаємного впливу. Під час їхнього зближення починають діяти сили відштовхування (рис. 12.2) між двома однаково зарядженими електронними оболонками атомів.
З ядрами атомів найменш міцно зв’язані електрони зовнішніх шарів, тож саме вони беруть участь в утворенні хімічних зв’язків. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
Пригадайте максимальне число електронів в атомі на першому енергетичному рівні. Поміркуйте, яка зовнішня оболонка буде стійкою для атомів хімічних елементів першого періоду.
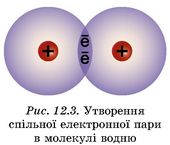
Коли електронні оболонки двох атомів Гідрогену перекриваються, то утворюють нову електронну оболонку (рис. 12.3). Вона подібна до завершеної електронної оболонки атома інертного елемента (назвіть, якого саме).
Мінімум енергії молекули відповідає строго визначеній відстані між ядрами атомів Гідрогену (рис. 12.1). Якщо атоми в молекулі під дією зовнішньої сили наблизити один до одного, почнеться потужне відштовхування між однойменно зарядженими ядрами атомів і загальна енергія системи почне стрімко зростати (рис. 12.1). Це енергетично невигідно системі, тому відстань між ядрами є строго певним, рівноважним значенням. Для молекули водню довжина хімічного зв’язку становить 0,74 ангстрема (740 пм).
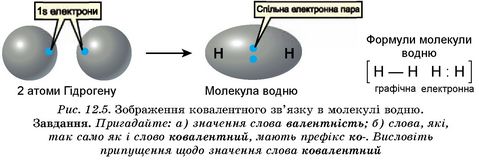
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул. Американський хімік Гілберт Льюіс (рис. 12.4) у 1916 р. запропонував позначати електрони крапками поруч із символами елементів. Одна крапка символізує один електрон (рис. 12.5).
Рис. 12.4. Льюіс Гілберт Ньютон (1875-1946). Американський фізико-хімік. Основні наукові праці присвячені теорії будови речовини й хімічній термодинаміці. Висловив припущення (1916), що хімічний зв’язок виникає шляхом утворення електронної пари, яка водночас належить обом атомам. Ця ідея послужила вихідним пунктом для розроблення сучасної теорії ковалентного зв’язку

Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
 |
|
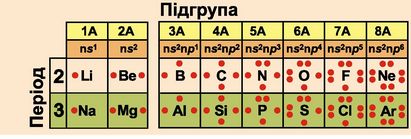
Рис. 12.6. Будова зовнішнього енергетичного рівня атомів елементів 2 і 3 періодів. Завдання. Складіть електронні та графічні формули двохатомних молекул: фтору, хлору, кисню, азоту. Пам’ятайте, що у графічній формулі кожній спільній електронній парі відповідає одна риска, яка символізує хімічний зв’язок. |
Електронегативність хімічного елемента (¾) - це властивість його атома притягувати спільні з іншим атомом електронні пари. Сучасне поняття про електронегативність було запроваджене американським науковцем Лайнусом Полінгом (рис. 12.7).
Полінг виразив електронегативність в умовних відносних одиницях. Як змінюється електронегативність хімічних елементів у періодах і групах періодичної системи? Видно, що найбільші значення електронегатив-ності мають неметалічні елементи (Флуор, Хлор, Оксиген, Нітроген),
а найменші - лужні. Тобто зі зростанням протонного числа електронега-тивність хімічних елементів збільшується в періодах і зменшується в підгрупах (рис. 12.8).
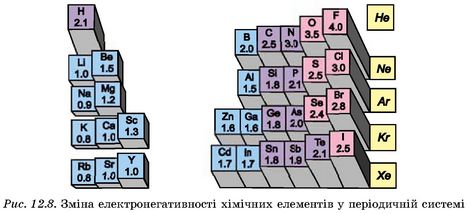
 |
Рис. 12.7. Полінг Лайнус Карл (1901-1994). Американський фізик і хімік. Роботи присвячені переважно вивченню будови молекул і природи хімічного зв’язку. Кількісно визначив (1932) поняття електронегативності, запропонував її шкалу. Заклав основи структурного аналізу білка. Лауреат Нобелівської премії (1954) |
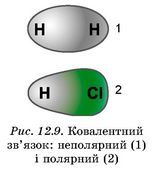 |
Електронегативність залежить не лише від відстані між ядром і валентними електронами, але й від того, наскільки валентна оболонка атома близька до завершеної. В одному періоді хімічний елемент, атом якого має сім електронів на зовнішній оболонці, виявлятиме вищу електронегативність, ніж елемент, в атомі якого на зовнішній оболонці один електрон. Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік більш електронегативного атома, називають полярним зв’язком (рис. 12.9). |
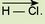
Складіть, використовуючи рис. 12.6, електронні та графічні формули летких сполук з Гідрогеном Карбону, Нітрогену, Оксигену, Флуору. Скористайтеся даними щодо відносної електронегативності цих елементів і позначте стрілкою напрямок зміщення спільних електронних пар, наприклад
Про ще один вид хімічного зв’язку ви дізнаєтеся з наступного параграфа.
ПРО ГОЛОВНЕ
• Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах.
• Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
• Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
• Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
• Електронегативність хімічного елемента - це властивість його атома притягувати спільні з іншим атомом електронні пари.
• Зі зростанням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
• Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік більш електронегативного атома, називають полярним зв’язком.
Перевірте себе
1. Яка природа хімічного зв'язку? 2. Що таке електронегативність? 3. Який зв'язок називають ковалентним неполярним? 4. Чим ковалентний полярний зв'язок відрізняється від ковалентного неполярного? 5. Як змінюється електронегативність хімічних елементів у періодичній системі?
Застосуйте свої знання й уміння
1. Виберіть правильне твердження. Ковалентним зв'язком сполучені атоми А металічних елементів
Б неметалічних і металічних елементів В неметалічних елементів Г інертних елементів
2. Укажіть формулу речовини з ковалентним полярним типом зв'язку.
А H2O Б N2 В PH3 Г O2
3. Під час утворення молекул у хімічних реакціях атоми хімічних елементів намагаються набути стійкої зовнішньої оболонки з
А трьох електронів Б чотирьох електронів В шістьох електронів Г вісьмох електронів
4. Для утворення хімічного зв'язку між двома атомами необхідно, щоб енергія системи з двох атомів була за енергію окремо взятих атомів
А нижчою Б вищою
5. Виберіть записи, у яких символи елементів розміщені за зменшенням їхньої електронегативності.
А Li, Be, C, O В H, Na, K, Cs
Б B, N, C, F Г F, Cl, Br, I
6. Правильним є запис (z - електронегативність)
А (H) < Z(Cl) Б Z(H) > Z(O) В z(F) < X(Br) Г z(H) > Z(N)
7. Порівняйте ковалентні зв'язки у молекулах водню і гідроген хлориду. Чим вони подібні і чим відрізняються?
Творча майстерня
Складіть казку про хімічний зв’язок або створіть комікс.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:01, Переглядів: 2886