Полярний і неполярний ковалентний зв’язок. Електронегативність елементів
Матеріал параграфа допоможе вам:
• зрозуміти, чому в молекулі на атомах різних елементів виникають електричні заряди;
• з’ясувати, яку властивість атома називають електронегативністю.
Складних речовин існує значно більше, ніж простих. Тому ковалентний зв’язок між різними атомами трапляється частіше, ніж між однаковими. У таких випадках спільні електронні пари, як правило, належать «більшою мірою» одному з атомів.
Розглянемо молекулу хлороводню HCl. Згідно з результатами досліджень, два електрони, що забезпечують ковалентний зв’язок у цій молекулі, частіше перебувають в атомі Хлору, ніж в атомі Гідрогену. Спільна електронна пара виявляється зміщеною до атома Хлору:
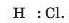
При цьому атом Хлору набуває невеликого негативного заряду, меншого за одиницю (він дорів-
нює —0,2), а атом Гідрогену — такого самого заряд>'за значенням, але позитивного (+0,2).
Для загального позначення дробових зарядів на атомах використовують грецьку літеру δ («дельта») разом зі знаком «+» або «-». Розглянуту особливість ковалентного зв’язку в молекулі хлороводню зображують так:
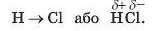
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік одного з атомів, називають полярним зв’ язком, а за відсутності такого зміщення — неполярним зв'язком.
Властивість атома елемента зміщувати у свій бік електронну пару, спільну з іншим атомом, називають елект-ронегативністю.
Зваживши на полярність ковалентного зв’язку в молекулі НС1, можна стверджувати, що Хлор — більш електронегативний елемент, ніж Гідроген.
Для кількісної оцінки електронегативності елементів використовують таблицю, складену американським ученим JI. Полінгом (табл. 6). Згідно з нею найменш електронегативним елементом є Цезій, а найбільш електронегативним — Флуор. Металічні елементи мають нижчі значення електронегативності, ніж неметалічні. Це й зрозуміло, оскільки атоми металічних елементів здатні втрачати електрони й перетворюватися на катіони, а атоми неметалічних елементів — приєднувати електрони й перетворюватися на аніони.
У періодах електронегативність елементів зростає зліва направо, а в групах (головних підгрупах) — знизу догори. 13
Значення електронегативності елементів 1—3 періодів
Таблиця 6
|
Період |
Групи |
|||||||
|
1 |
ГІ |
III |
IV |
V |
VI |
VII |
VIII |
|
|
1 |
 |
 |
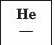 |
|||||
|
2 |
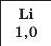 |
 |
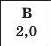 |
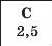 |
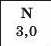 |
 |
 |
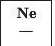 |
|
3 |
 |
 |
 |
 |
 |
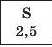 |
 |
 |
Передбачити полярність чи неполярність ковалентного зв’язку, користуючись таблицею електронегативності, дуже просто. Якщо атоми мають однакову електронегативність, то зв’язок між ними неполярний. Неполярні ковалентні зв’язки існують, наприклад, у молекулах N2, PH3, CS2. Атоми неметалічних елементів із різною електронегативністю сполучаються полярними ковалентними зв’язками.
Цікаво знати
Електричний заряд на кожному атомі Гідрогену в молекулі води становить +0,17, а на атомі Оксигену -0,34.
Розглянемо молекулу води H2O. Між атомом Оксигену і кожним атомом Гідрогену існує простий ковалентний зв’язок; таких зв’язків у молекулі — два. Оскільки Оксиген має вищу електронегативність (3,5), ніж Гідроген (2,1), то його атом зміщує до себе спільні електронні пари:
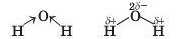
Отже, ковалентні зв’язки у молекулі води є полярними.
Чим більша різниця електронегативності елементів, тим полярніиіим є зв’язок між атомами.
Якщо ковалентний зв'язок утворюється між атомами різних елементів, то вони здебільшого набувають невеликих зарядів. їх поява спрігчн-нена зміщенням спільних електронних пар від одних атомів до інших. Такий ковалентний зв’язок називають полярним. Якщо зміщення спільних електронних пар немає, то зв'язок є неполярним.
Властивість атома зміщувати до себе електронну пару, спільну з іншим атомом, називають електронегативністю. Електронегатив-ність елементів зростає в періодах зліва направо, а в групах (головних підгрупах) — знизу догори.
104. Чому на атомах, сполучених ковалентним зв'язком, можуть виникати невеликі заряди? Який ковалентний зв'язок називають полярним, а який — неполярним?
105. Що таке електронегативність елемента?
106. Підкресліть у кожній із формул речовин символ найбільш електронегативного елемента: AICI3l CF4, SO2, NaH, N2O5, LiOH1 HCIO4. Використайте дані, наведені в таблиці 6.
107. Серед наведених формул укажіть ті, що відповідають речовинам із йонним, ковалентним неполярним і ковалентним полярним зв'язком: HF, CO2, MgO1 Li3Nr Br2, NCI3. Поясніть ваш вибір.
108. Позначте заряди на атомах, використавши літеру δ, у таких молекулах: OF2, NH3, SCI4, SiH4. Який зі зв’язків у цих молекулах найбільш полярний, а який — найменш полярний?
109. За даними таблиці 6 складіть ряд неметалічних елементів, у якому електронегативність зменшується зліва направо.
110. Як змінюється електронегативність елементів у періодах і головних підгрупах періодичної системи?
111. Укажіть правильне закінчення речення «Значення електронега-тивності Калію та Кальцію становлять відповідно ...»:
а) 0,8 і 1,0; в) 1,0 і 1,2;
б) 1,0 і 0,8; г) 0,8 і 0,6.
Візьміть до уваги і порівняйте значення електронегативності елементів, подібних до Калію і Кальцію, скориставшись таблицею 6.
112. Елементи в хімічних формулах сполук часто записують у порядку зростання їхньої електронегативності. Укажіть серед наведених формул такі, у яких дотримано цю послідовність: Na2CO3, NH3, SiO2, H2S1 NaOH, CH4, HNO3.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:48, Переглядів: 6927