§ 35. Химические свойства кислот
Вспомните:
• для определения растворимости веществ в воде используют таблицу растворимости;
• как обнаруживают щелочи в растворе (§ 33);
• принцип кислотно-осн0вных взаимодействий (§ 30);
• условия, при которых протекают реакции обмена (§ 33).
Обнаружение кислот
Как и щелочи, кислоты можно выявить при помощи индикаторов. Цвет индикаторов при наличии и отсутствии кислот в растворе приведен в таблице 11.
Таблица 11. Цвет индикаторов при наличии и отсутствии кислот
|
Индикатор |
Цвет в растворе |
|
|
при наличии кислот (кислая среда) |
при отсутствии кислот (нейтральная среда) |
|
|
Лакмус |
Красный |
Фиолетовый |
|
Метиловый оранжевый |
Красный |
Оранжевый |
|
Фенолфталеин |
Бесцветный |
Бесцветный |
|
Универсальный |
Красный |
Желтый |
Взаимодействие кислот с веществами основной природы
Вы уже изучили реакции основных оксидов и оснований с кислотами. Между ними происходят реакции обмена, в которых образуются соль и вода:
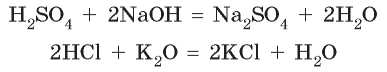
Амфотерные оксиды и амфотерные гидроксиды при взаимодействии с кислотами проявляют свойства основных веществ, т. е. реагируют как обычные основные оксиды и гидроксиды:
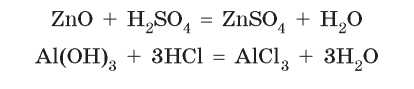
Взаимодействие кислот с солями
Кислоты могут вступать в реакции с солями (как растворимыми в воде, так и нерастворимыми). Между кислотой и солью происходит реакция обмена, поэтому продуктами реакции должны быть также соль и кислота.
Взаимодействие между солью и кислотой происходит, если реакция соответствует условиям протекания реакций обмена:
• кислота или соль, которая образуется, выпадает в осадок:
Например, при взаимодействии барий хлорида с сульфатной кислотой образуется белый осадок нерастворимой соли — барий сульфата:
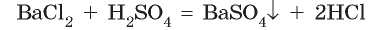
Среди известных вам кислот нерастворимой является силикатная кислота. Она образуется в реакции растворимых силикатов с кислотами:
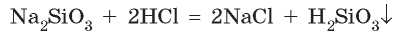
• происходит выделение газообразного вещества, которое возможно, если образованная кислота неустойчивая или летучая:
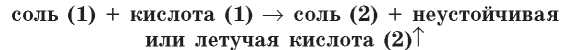

При взаимодействии карбонатов или сульфитов с кислотами образуются неустойчивые кислоты (карбонатная и сульфитная), которые при образовании разлагаются:
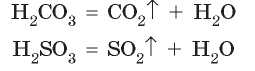
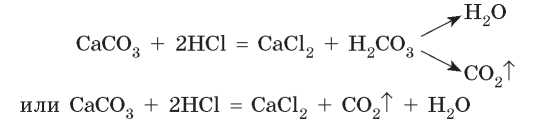
Поэтому такие соли активно реагируют с кислотами. Например, при действии на порошок кальций карбоната (известняк, мел, мрамор) хлоридной кислоты жидкость словно закипает, поскольку образованная карбонатная кислота моментально разлагается с выделением углекислого газа (рис. 35.1):

Аналогично происходит реакция взаимодействия натрий сульфита с кислотой:
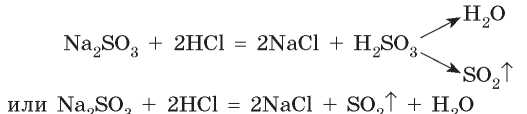
Некоторые кислоты являются летучими и плохо растворяются в воде, как, например, сульфидная кислота H2S. При действии хло-ридной кислоты на феррум(П) сульфид реакция происходит благодаря выделению из раствора гидроген сульфида (сероводорода):
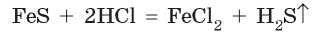
Необходимо помнить, что реакции кислот с солями не всегда возможны, даже если формально реакция соответствует условиям протекания реакций обмена. Так, если смешать растворы феррум(Н) хлорида и сульфидной кислоты, то реакция не будет протекать, хотя в результате должен был образоваться осадок:
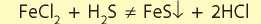
Причина заключается в силе кислот. Кислоты разделяют на сильные и слабые. Сильными кислотами являются H2SO4, HNO3, HCl, HBr и HI. Другие кислоты, которые приведены в таблице 8, являются слабыми. Хлоридная кислота — сильная, а сульфидная — слабая. Взаимодействие феррум(П) хлорида с сульфидной кислотой не происходит, так как слабая кислота не может вытеснить сильную из соли. А сильная кислота может вытеснить слабую из соли:
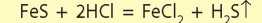
Таким образом, все сильные кислоты способны взаимодействовать с солями всех слабых кислот. Несмотря на то что многие слабые кислоты растворимы в воде, сильные кислоты способны вытеснить их даже в том случае, если все продукты реакции растворимы в воде. Например, сульфатная кислота может вытеснить ортофосфатную из нерастворимых ортофосфатов:
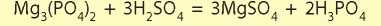
Безопасность при работе с кислотами
Кислоты — едкие вещества. При попадании на кожу или слизистые оболочки кислоты могут стать причиной химических ожогов, а в случае попадания концентрированной сульфатной кислоты — даже обугливания кожи. Под воздействием кислоты на одежде могут появиться дырки. Поэтому с кислотами, особенно с концентрированными, следует обращаться очень осторожно. Работать с ними желательно в резиновых перчатках. Если кислота случайно попала на кожу или одежду, ее следует немедленно смыть большим количеством воды, а остатки нейтрализовать разбавленным раствором соды.
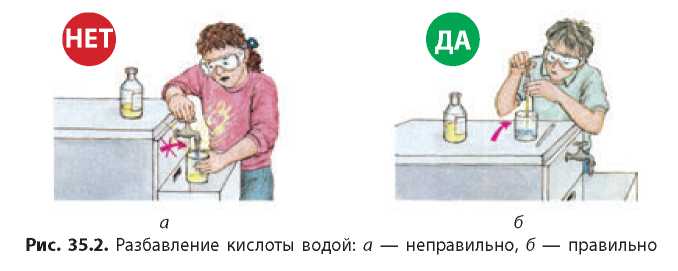
При растворении концентрированных кислот в воде выделяется большое количество теплоты. Если наливать воду в емкость с концентрированной кислотой, то вода собирается на поверхности (плотность концентрированных кислот больше плотности воды) и под действием теплоты может закипеть и начать разбрызгиваться вместе с кислотой. Поэтому, разбавляя концентрированные кислоты, обязательно следует наливать кислоту в емкость с водой, а не наоборот (рис. 35.2).
Действие водных растворов кислот на индикаторы
Оборудование: штатив с пробирками, пипетки.
Реактивы: 5%-й раствор хлоридной кислоты, раствор сульфатной кислоты, лакмус, метиловый оранжевый, фенолфталеин и универсальный индикатор.
Правила безопасности:
•используйте небольшие количества реактивов;
• при определении запаха веществ не подносите сосуд к лицу, а направляйте воздух движениями руки к себе;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза; в случае попадания кислоты ее следует смыть большим количеством воды и промыть кожу разбавленным раствором соды.
1. Откройте емкость с 5%-м раствором хлоридной кислоты. Проверьте, есть ли у нее запах.
2. Налейте в четыре пробирки по 1 мл раствора хлоридной кислоты.
3. В первую пробирку добавьте 1-2 капли раствора лакмуса, во вторую — метилового оранжевого, в третью — фенолфталеина, в четвертую — универсального индикатора. Как изменился цвет индикаторов?
4. Выполните аналогичные действия с раствором сульфатной кислоты.
5. Запишите наблюдения в тетрадь. Что общего между хлоридной и сульфатной кислотами? Чем они отличаются? Сравните результаты вашего опыта с данными из таблицы 11 на с. 185.
Действие на сок свеклы лимонного сока, раствора пищевой соды, мыльного раствора
Вам понадобятся: кастрюля, стаканы, свекла, нож, воронка, фильтровальная бумага или фильтр для кофеварки, лимонный сок, уксус, пищевая сода, стиральный порошок и раствор мыла.
Правила безопасности:
• используйте небольшие количества веществ;
• остерегайтесь попадания кислых веществ на кожу, в глаза; в случае попадания вещество следует смыть большим количеством воды;
• помните, что горячие и холодные предметы одинаковые на вид, пользуйтесь защитными перчатками.
В некоторых растениях есть вещества, которые можно использовать в качестве индикаторов. Для начала следует получить раствор индикатора из свеклы. Это можно сделать разными способами: выжать сок из свеклы при помощи соковыжималки или приготовить отвар из свеклы. Для приготовления отвара нарежьте небольшую

свеклу тонкими ломтиками или соломкой. Поместите ее в кипяток (приблизительно 0,5 л), чтобы отвар получился достаточно концентрированным. Дайте покипеть несколько минут, после этого охладите и отфильтруйте отвар от остатков свеклы с использованием бумажного фильтра или фильтра для кофеварки (рис. 35.3).
Приготовьте шесть стаканов и налейте в каждый по 50 мл воды. В первый стакан добавьте столовую ложку уксуса, во второй — сок одного лимона, в третий насыпьте половину чайной ложки соды, в четвертый — столько же стирального порошка, в пятом стакане растворите небольшой кусочек мыла, а в шестом оставьте чистую воду для сравнения. Можно также подготовить стакан с рассолом от маринованных огурцов или помидоров, с соком квашеной капусты, свежим и кислым молоком.
В каждый стакан прилейте небольшой объем (5-10 капель) сока или отвара свеклы. Как изменяется цвет?
Запишите свои наблюдения в тетрадь. Сделайте выводы:
1) как изменился цвет сока (отвара);
2) в каких стаканах находились кислоты, а в каких — щелочи;
3) можно ли сок (отвар) свеклы использовать как индикатор.
Этот эксперимент можно повторить, взяв вместо свеклы краснокочанную капусту, чернику, лепестки фиалок, сирени, ирисов или других яркоокрашенных цветов, а также обычную зеленку (раствор «Бриллиантового зеленого» из домашней аптечки).
Выводы
1. Для обнаружения кислот используют те же самые индикаторы, что и для обнаружения щелочей. Лакмус, метиловый оранжевый и универсальный индикатор при наличии кислот меняют свой цвет на красный, а фенолфталеин остается бесцветным.
2. Кислоты реагируют с веществами основной природы: основаниями и основными оксидами. В результате такого взаимодействия образуются соль и вода. Амфотерные оксиды и амфотерные гидроксиды реагируют с кислотами так же.
3. Кислоты способны вступать с солями в реакции обмена. При этом образуются другие кислота и соль. Реакция будет протекать в случае образования летучей или неустойчивой кислоты либо при образовании нерастворимой соли или кислоты.
4. Кислоты — едкие вещества, с которыми следует обращаться очень осторожно. При разбавлении кислот необходимо вливать кислоту в воду, а не наоборот. При попадании кислоты на кожу или одежду ее следует немедленно смыть водой и нейтрализовать остатки раствором соды.
Контрольные вопросы
1. Вещества какого класса соединений образуются при взаимодействии кислоты с основанием или основным оксидом?
2. Какие вещества образуются в ходе реакции обмена между кислотой и солью?
Задания для усвоения материала
1. Составьте уравнения реакций нитратной кислоты с магний оксидом и магний гидроксидом.
2. Составьте уравнения реакций сульфатной кислоты с такими соединениями: купрум(іі) гидроксид, кальций гидроксид, алюминий оксид, цинк гидроксид, калий сульфит, натрий сульфид, калий карбонат. Во всех случаях определите, благодаря чему протекает реакция обмена.
3. Какие оксиды при взаимодействии с хлоридной кислотой образуют следующие соли: CaCl2, HgCl2, FeCl3? Составьте уравнения этих реакций.
4. Какие из приведенных веществ можно использовать для поглощения углекислого газа из воздуха: раствор натрий гидроксида, раствор сульфатной кислоты, фосфор(У) оксид, кальций гидроксид, кальций оксид? Ответ подтвердите уравнениями реакций.
5. Дополните схемы реакций, укажите названия продуктов реакций:
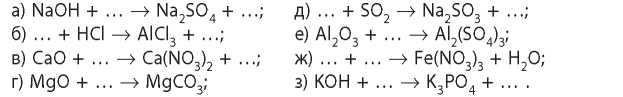
6. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Mg ^ MgO ^ MgSO4; б) Cu ^ CuO ^ Cu(NO3)2.
7. Сравните массы образцов веществ: ортофосфатная кислота количеством 3 моль и нитратная кислота количеством 4 моль.
8. Вычислите количество вещества атомов Оксигена, которое содержится: а) в 0,25 моль сульфитной кислоты; б) 15,6 г силикатной кислоты.
9. Газ, который при растворении в воде образует кислоту, имеет относительную плотность по воздуху 1,17. Составьте формулу этой кислоты. Составьте уравнение получения этого газа из простых веществ.
10. Кальций карбонат массой 20 г полностью прореагировал с хлоридной кислотой. Вычислите объем выделившегося газа (н. у.).
11. Раствор натрий силиката массой 61 г с массовой долей соли 2 % смешали с избытком хлоридной кислоты. Вычислите массу образованного осадка.
12*. Как вы считаете, почему сульфатную кислоту называют «матерью всех кислот»? Раскройте ее значение в промышленности.
13*. К каким последствиям, по вашему мнению, приводит попадание кислот в почвы или водоемы? В дополнительных источниках информации найдите примеры таких случаев.
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:46, Переглядів: 4336