§ 33. Химические свойства щелочей и нерастворимых гидроксидов
Вспомните:
• как отличить формулы щелочей, нерастворимых оснований и амфотерных гидроксидов (§ 28);
• принцип кислотно-осн0вных взаимодействий; как определить кислоту, соответствующую тому или иному кислотному оксиду (§ 30).
Обнаружение щелочей
Щелочи и кислоты — бесцветные в воде вещества, но очень часто необходимо знать, присутствует ли кислота или щелочь в растворе. Для обнаружения щелочей и кислот используют индикаторы — сложные органические вещества, которые изменяют свой цвет в зависимости от наличия щелочей или кислот в растворе. Нерастворимые и амфотерные гидроксиды не изменяют цвет индикаторов.
Обычно индикаторы используют в виде растворов — водных или спиртовых. Удобнее использовать индикаторную бумагу — полоски обычной бумаги, пропитанной раствором индикатора, а затем высушенной (рис. 33.1).
Наиболее используемые в школьной лабораторной практике индикаторы — это лакмус (рис. 33.2), фенолфталеин (рис. 33.3), метиловый оранжевый и универсальный индикатор (рис. 33.4). Цвета индикаторов при наличии и отсутствии щелочей приведены в таблице 10.


Таблица 10. Цвет индикаторов при наличии и отсутствии щелочей
|
Индикатор |
Цвет в растворе |
|
|
при наличии щелочи (щелочная среда) |
при отсутствии щелочи (нейтральная среда) |
|
|
Лакмус |
Синий |
Фиолетовый |
|
Метиловый оранжевый |
Желтый |
Оранжевый |
|
Фенолфталеин |
Малиновый |
Бесцветный |
|
Универсальный |
Синий |
Желтый |
Взаимодействие щелочей и нерастворимых гидроксидов с кислотами. Реакция нейтрализации
В § 30 мы уже рассмотрели кислотно-основные взаимодействия, принцип которых заключается в том, что вещества с кислотными свойствами реагируют с веществами с основными свойствами.
Щелочи и нерастворимые гидроксиды проявляют основные свойства и способны взаимодействовать с кислотами:

В продукт реакции — соль — переходит металлический элемент из основания и кислотный остаток из кислоты:
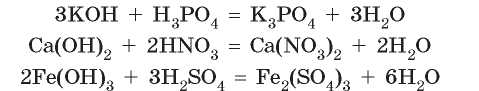
Щелочи и кислоты — едкие вещества, а в результате их взаимодействия образуется нейтральная соль. Таким образом, щелочь и кислота взаимно нейтрализуют друг друга, из-за чего реакцию между ними называют реакцией нейтрализации. Хотя нерастворимые гидроксиды не являются едкими, их взаимодействие с кислотами также часто называют реакцией нейтрализации.
Реакцию между кислотой и основанием, в результате которой образуются соль и вода, называют реакцией нейтрализации.
Реакции обмена
Обратите внимание на перемещение атомов в реакции натрий гидроксида с хлоридной кислотой:
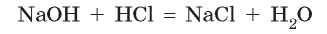
Натрий гидроксид состоит из двух частей (иона Натрия и гидроксид-иона), и хлоридная кислота состоит из двух частей (иона Гидрогена и кислотного остатка — хлорид-иона). При взаимодействии между ними происходит обмен этими частями — ионы Натрия и Гидрогена поменялись местами: ион Гидрогена кислоты объединился с гидроксид-ионом щелочи в молекулу воды, а ион Натрия с кислотным остатком образовал соль — натрий хлорид:
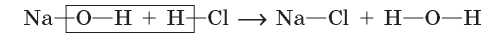
Следовательно, это реакция обмена.
Реакции, в которых два вещества обмениваются своими частями, называют реакциями обмена.
Условия протекания реакций обмена в водных растворах
Большинство реакций, которые характеризуют химические свойства оснований, кислот и солей, — это реакции обмена. Реакции обмена в водных растворах могут протекать только при определенных условиях, которые соответствуют правилу: продукты реакции не должны реагировать друг с другом с образованием исходных веществ. Такие реакции называют необратимыми, т. е. такие, которые происходят до конца. Это возможно, если одним из продуктов реакции является вода или продукт реакции выделяется из раствора в виде газа или осадка (нерастворимого в воде вещества).
|
Реакции обмена в водных растворах происходят при условии, что |
||
 |
 |
 |
|
образуется вода |
выделяется газ |
выпадает осадок |
|
(при взаимодействии |
(обычно это CO2, SO2, |
(нерастворимое в воде |
|
кислот и кислотных оксидов с основаниями и основными оксидами) |
H2S или NH3) |
вещество) |
Обратите внимание: если одним из реагентов является нерастворимое в воде вещество и должно образоваться также нерастворимое вещество, то осадок образуется на поверхности нерастворимого реагента. В такой реакции смогут прореагировать только поверхностные слои реагента, значит, вглубь частицы осадка реакция не пойдет.
Таким образом, реакция обмена, в которую вступает нерастворимое вещество и в результате которой должен образоваться осадок, не происходит. Иначе говоря, «из осадка осадок не образуется».
Взаимодействие щелочей с кислотными оксидами
Щелочи также способны взаимодействовать с кислотными оксидами. Такие реакции мы уже рассмотрели в § 30, когда изучали свойства оксидов:

Вы уже знаете, что главное при составлении уравнений таких реакций — правильно определить кислотный остаток. Для этого необходимо помнить, как определить кислоту, соответствующую данному кислотному оксиду (табл. 9, с. 158).
Сульфур(^) оксиду соответствует сульфитная кислота, а фосфор^) оксиду — ортофосфатная, поэтому со щелочами сульфур(^) оксид будет образовывать сульфиты (соли сульфитной кислоты), а фосфор^) оксид — ортофосфаты:
Ca^^2 + SО2 = CaSО3i + Н2О (8О2 соответствует Н^О3) 6NaOH + P^5 = 2Na3PO4 + 3Н2О (P^5 соответствует ^PO4) Нерастворимые и амфотерные гидроксиды в такие реакции не вступают.
Взаимодействие щелочей с солями
Гидроксиды вступают с солями в реакции обмена, поэтому в результате образуются также соль и гидроксид. Такие реакции должны соответствовать условиям протекания реакций обмена, поэтому среди реагентов все вещества должны быть растворимыми, а в результате должен образоваться осадок:

Разложение нерастворимых гидроксидов
Нерастворимые и амфотерные гидроксиды — неустойчивые вещества. При нагревании (в отличие от щелочей) они разлагаются с образованием соответствующих оксидов и воды:
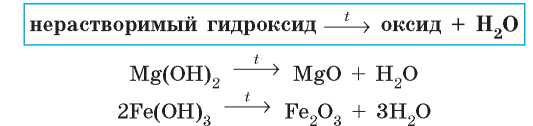
Таким способом можно получить оксиды даже тех элементов, которые в виде простого вещества не реагируют с кислородом, например аурум(Ш) оксид:
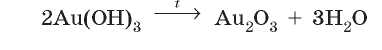
Безопасность при работе со щелочами
Щелочи — едкие вещества, они разъедают кожу, дерево, бумагу, могут стать причиной ожогов кожи и слизистых оболочек (рис. 33.5).

Недаром натрий гидроксид называют едким натром, а калий гидроксид — едким кали. Шерстяная ткань, погруженная в концентрированный раствор натрий гидроксида, набухает и превращается в студенистую массу. Если раствор щелочи, попавший на руку, не смыть водой, кожу начинает жечь, и в скором времени образуется язва.
При работе со щелочами особенно важно беречь глаза, поэтому рекомендуется надевать защитные очки. Если щелочь случайно попала на кожу, ее следует немедленно смыть большим количеством проточной воды, а затем протереть поврежденный участок кожи разбавленным раствором боратной или уксусной кислоты.
• Слово «щелочь» происходит от устаревшего слова, которым раньше называли мылкий раствор древесной золы, используемый для стирки и мытья.
• Открытие лакмуса является примером так называемых «случайных» открытий. Как-то английский ученый Роберт Бойль приготовил водный раствор лакмусового лишайника. Стакан, в котором он хранил настой, понадобился ему для хлоридной кислоты. Вылив настой, Бойль влил в стакан кислоту и с удивлением обнаружил, что кислота стала красной. Изучая этот эффект, Бойль изобрел первый индикатор для кислот и щелочей.
Лингвистическая задача
Термин «нейтрализация» есть во многих языках и происходит от латинского слова. На латыни uter означает «кто-то из двух», «тот или другой». Соответственно neuter — «ни тот, ни другой». Как вы считаете, благодаря какой особенности реакция нейтрализации получила именно такое название?
Действие водных растворов щелочей на индикаторы
Оборудование: штатив с пробирками, пипетки.
Реактивы: натрий гидроксид, калий гидроксид, вода, метиловый оранжевый, фенолфталеин, лакмус, универсальный индикатор. Правила безопасности:
• при выполнении опытов используйте небольшие количества реактивов;
• остерегайтесь попадания щелочи на одежду, кожу, в глаза; в случае попадания немедленно смойте вещество большим количеством воды и протрите место разбавленным раствором боратной кислоты.
1. Рассмотрите выданные вам в пробирках образцы гидроксидов Натрия и Калия. В каком агрегатном состоянии они находятся?
2. Долейте в каждую пробирку по 3 мл воды и аккуратно перемешайте, постукивая по пробирке пальцем. Что наблюдаете? Какой вывод можно сделать о растворимости этих веществ в воде? Сравните полученные результаты с данными таблицы растворимости.
3. Разделите содержимое каждой пробирки на четыре части. Добавьте по 2-3 капли: в первую пробирку — раствора лакмуса, во вторую — метилового оранжевого, в третью — фенолфталеина, а в четвертую — универсального индикатора. Отметьте цвет индикаторов.
4. Сделайте вывод о возможности выявления щелочей индикаторами.
Взаимодействие щелочей с кислотами в растворе
Оборудование: штатив с пробирками, пипетки.
Реактивы: растворы натрий гидроксида, фенолфталеина, сульфатной кислоты.
Правила безопасности:
• при выполнении опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза; в случае попадания немедленно смойте вещество большим количеством воды и протрите место разбавленным раствором: если щелочь — раствором боратной кислоты, если кислота — раствором соды.
1. Налейте в пробирку натрий гидроксид объемом 1-2 мл и добавьте 1-2 капли раствора фенолфталеина. Что вы наблюдаете?
2. Доливайте к щелочи по каплям раствор сульфатной кислоты, пока раствор обесцветится. О чем свидетельствует изменение цвета индикатора?
3. Составьте уравнение реакции.
4. Сделайте вывод о признаках реакции нейтрализации и возможности доказательства факта нейтрализации щелочи.
Выводы
1. Для обнаружения щелочей в растворе используют кислотно-основные индикаторы — вещества, изменяющие цвет при наличии щелочи или кислоты. В растворах щелочей лакмус изменяет свой цвет на синий, метиловый оранжевый — на желтый, фенолфталеин — на малиновый, универсальный индикатор становится синим.
2. В реакции щелочи с кислотой образуются соль и вода. Такие реакции называют реакциями нейтрализации. Такие же продукты образуются при взаимодействии щелочей с кислотными оксидами.
3. Химические реакции, в которых вещества обмениваются своими составляющими частями,называют реакциями обмена. Реакции обмена являются необратимыми, т. е. они протекают до конца: в результате реакции образуются вода, газ или нерастворимое в воде вещество. Реакция нейтрализации — пример реакции обмена.
4. Реакции обмена возможны между щелочами и растворимыми солями, при этом образуются нерастворимый гидроксид и соль.
5. При нагревании разложению подвергаются только нерастворимые гидроксиды. В результате образуются соответствующий оксид и вода.
Контрольные вопросы
1. Какие реакции называют реакциями нейтрализации? Приведите пример.
2. Какие реакции называют реакциями обмена? Приведите пример.
3. Какие реакции называют необратимыми?
4. При каких условиях могут протекать реакции обмена?
5. Благодаря каким свойствам едкий натр и едкий кали получили свои названия?
6. Какие вещества называют индикаторами? Какой цвет приобретают лакмус и метиловый оранжевый: а) в воде; б) в растворе щелочи?
7. Как изменяет окраску фенолфталеин в растворах щелочей: а) на желтую; б) фиолетовую; в) малиновую?
8. Реакцию KOH + HCl = KCl + H2O называют реакцией: а) нейтрализации; б) замещения; в) разложения.
9. Как следует обращаться со щелочами? Что необходимо делать при попадании щелочей на кожу или слизистые оболочки?
Задания для усвоения материала
1. Растворы соды, мыла и силикатного клея изменяют окраску фенолфталеина на малиновую. Какой вывод можно сделать о свойствах этих соединений?
2. Запишите названия оснований: LiOH, Mg(OH)2, Ni(OH)2, RbOH. Составьте формулы солей, образованных этими основаниями при их взаимодействии с сульфатной кислотой, и запишите их названия.
3. Составьте уравнения реакций нейтрализации раствора барий гидроксида хлоридной, сульфатной, нитратной и ортофосфатной кислотами. По таблице растворимости определите, в каких случаях образуется осадок.
4. Составьте уравнения реакций нейтрализации указанных оснований хлоридной кислотой: калий гидроксид, феррум(И) гидроксид, феррум(Ш) гидроксид, магний гидроксид, цинк гидроксид.
5. Составьте уравнения реакций нейтрализации, в результате которых образуются соли: K2SO4, Mg(NO3)2, ZnSO4, CaG2, Al(NO3)3.
6. Составьте уравнения реакций получения натрий карбоната, калий силиката, кальций сульфита взаимодействием кислотных оксидов со щелочами.
7. Какие из солей реагируют с калий гидроксидом: натрий карбонат, купрум(П) сульфат, алюминий нитрат, барий карбонат? Составьте соответствующие уравнения реакций.
8. Составьте уравнения разложения гидроксидов: Феррума(Ш), Мангана(П), Меркурия(И), Купрума(І).
9. Гидроксиды Феррума(П), Магния, Цинка, Кальция при нагревании разлагаются на соответствующий оксид и воду. Составьте уравнения реакций.
10. Вычислите массу натрий карбоната, образующегося при пропускании углекислого газа объемом 31,36 л (н. у.) через раствор натрий гидроксида.
11. Вычислите массу феррум(Ш) оксида, необходимую для получения феррум(Ш) нитрата массой 36,3 г.
12. Вычислите массу алюминий гидроксида, необходимую для получения алюминий оксида массой 35,7 г.
13. Вычислите массу соли, которая образуется при взаимодействии натрий гидроксида массой 80 г с раствором хлоридной кислоты.
14. К раствору барий гидроксида, который содержит 8,55 г щелочи, добавили достаточное количество феррум(П) хлорида. Вычислите массу осадка.
15. Вычислите массу ортофосфатной кислоты, необходимую для нейтрализации раствора, который содержит 153,9 г барий гидроксида.
16. Вычислите объем кислорода (н. у.), необходимый для сжигания угля массой 12 г. Какая масса кальций гидроксида понадобится, чтобы поглотить весь образовавшийся оксид?
17. Раствор калий гидроксида массой 280 г с массовой долей щелочи 4 % нейтрализовали сульфатной кислотой. Вычислите массу образованной в результате реакции соли.
18. Через раствор калий гидроксида массой 200 г, содержащего 8,4 г щелочи, пропустили сульфур(^) оксид до полной нейтрализации щелочи. Определите массовую долю соли в образованном осадке.
194. Найдите в дополнительных источниках информации примеры использования гидроксидов для улучшения свойств почв и воды. Какое влияние на окружающую среду будут иметь случаи бесконтрольного попадания щелочей в почвы или водоемы?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:45, Переглядів: 4621