§ 39. Амфотерные оксиды и гидроксиды
Вспомните:
• химические элементы, которые образуют амфотерные вещества (§ 28);
• как относятся амфотерные оксиды и гидроксиды к воде и кислотам (§ 30 и 35).
Понятие об амфотерности
Вы уже изучили соединения, которые проявляют кислотные или основные свойства. Некоторые соединения могут проявлять и кислотные, и основные свойства. Кислотные свойства проявляют главным образом соединения неметаллических элементов, а основные — металлических элементов. Если элемент находится на границе между металлическими и неметаллическими элементами, то вполне ожидаемо, что его соединения должны проявлять свойства, характерные как для кислотных, так и для основных веществ. Такие соединения называют амфотерными.
Вещества, которые могут проявлять кислотные и основные свойства I в зависимости от вещества, с которым они взаимодействуют, называют амфотерными.
Амфотерные свойства могут проявлять оксиды и гидроксиды некоторых химических элементов в степенях окисления +2, +3 и +4. Среди них Бериллий(+2), Цинк(+2), Станнум(+2), Плюмбум(+2), Алюминий(+3), Феррум(+3), Хром(+3), Титан(+4).
Амфотерные гидроксиды
При взаимодействии с кислотами амфотерные гидроксиды ведут себя как обычные нерастворимые основания: продуктами 4 реакции амфотерного гидроксида с кислотой являются соль и вода:
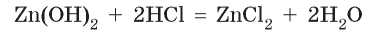
При взаимодействии с другими основаниями амфотерные гидроксиды проявляют кислотные свойства: с основаниями амфотерные гидроксиды реагируют, как кислоты — вступают в реакцию с образованием соли. Но состав соли зависит от условий, при которых происходит взаимодействие: в растворе или при сплавлении.
В растворах амфотерные гидроксиды взаимодействуют только со щелочами с образованием сложных (комплексных) солей.
Например, цинк гидроксид с натрий гидроксидом реагирует по уравнению:
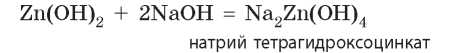
Как и для обычных солей, название комплексной соли составляют из двух слов. Однако следует указать число групп ОН в составе соли: префикс тетра- означает, что гидроксильных групп четыре, а префиксом гекса- обозначают шесть групп ОН, например:

Подобно цинк гидроксиду реагирует со щелочами и алюминий гидроксид. Но в зависимости от концентрации щелочи из алюминий гидроксида может образоваться тетрагидроксоалюминат (с разбавленным раствором щелочи) или гексагидроксоалюминат (с концентрированным раствором):
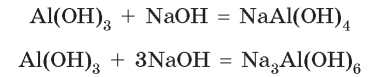
При сплавлении амфотерные гидроксиды могут взаимодействовать не только со щелочами, но и с нерастворимыми гидроксидами. При этом образуются также соли, но с более простым составом:
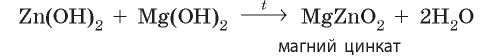
Как и в растворах, из алюминий гидроксида могут образоваться две разные соли в зависимости от количества добавленной щелочи:
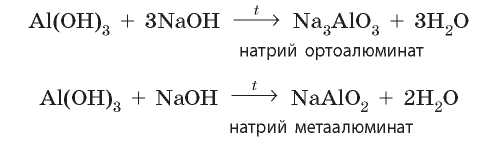
При сплавлении амфотерные гидроксиды могут взаимодействовать также и с основными оксидами:
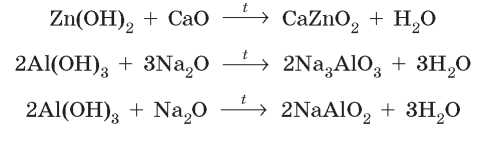
Для того чтобы правильно записать уравнение реакции с участием амфотерных гидроксидов при сплавлении, амфотерные гидроксиды необходимо рассматривать как кислоты. Так, формулу цинк гидроксида Zn(OH)2 можно записать как формулу кислоты H2ZnO2. Эта кислота будет называться цинкатной, она имеет кислотный остаток ZnO2 с зарядом -2, ее соли — цинкаты. Также формулу алюминий гидроксида можно записать H3AlO3: кислотный остаток AlO3 с зарядом -3, соли — ортоалюминаты. Если из алюминий гидроксида убрать одну молекулу воды, то формула кислоты будет HAlO2: кислотный остаток AlO2 с зарядом -1, а соли — метаалюминаты.
Амфотерные оксиды
С кислотами амфотерные оксиды взаимодействуют как обычные основные оксиды: между ними происходят реакции обмена, в которых образуются соль и вода:
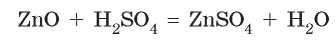
При взаимодействии с основными веществами они вступают в реакции как кислотные оксиды. То есть взаимодействуют с основными оксидами и основаниями с образованием солей. Но амфотерные оксиды взаимодействуют с основаниями и основными оксидами только при сплавлении (без участия воды) и образуют такие же соли, как и амфотерные гидроксиды.
При сплавлении цинк оксида с натрий гидроксидом или натрий оксидом образуется натрий цинкат, только в первом случае образуется еще и вода:
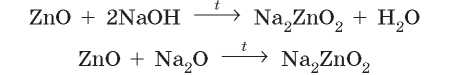
Амфотерные оксиды и их соединения довольно распространены в природе. Алюминаты являются составляющими почв и глины.
Некоторые элементы проявляют переменную валентность, причем свойства соединений с разными валентностями могут существенным образом отличаться. Так, феррум(П) оксид FeO — это основный оксид, а феррум(ііі) оксид Fe2O3 — амфотерный. Таким образом, они могут взаимодействовать друг с другом при сплавлении, причем образованный продукт также состоит из атомов Феррума и Оксигена — Fe3O4. Это соединение называют смешанным оксидом (или железной окалиной), хотя оно является солью, которая состоит из металлического элемента Феррума(іі) и кислотного остатка ферратной кислоты Fe(FeO2)2.
Выводы
1. Амфотерность — способность химических соединений проявлять как кислотные, так и основные свойства в зависимости от природы добавленного реагента. К амфотерным относятся оксиды и гидроксиды некоторых элементов: Бериллия(+2), Цинка(+2), Станнума(+2), Плюмбу-ма(+2), Алюминия(+3), Феррума(+3), Хрома(+3), Титана(+4).
2. Амфотерные гидроксиды в растворах взаимодействуют только со щелочами с образованием солей, которые содержат гидроксильные группы. При сплавлении они могут также взаимодействовать с основными оксидами и гидроксидами. Амфотерные оксиды взаимодействуют с основными веществами только при сплавлении.
Контрольные вопросы
1. Что означает выражение «соединение проявляет амфотерные свойства»?
2. Какие соединения являются амфотерными? Приведите примеры.
3. Какие химические элементы и в каких валентностях образуют амфотерные вещества?
Задания для усвоения материала
1. Составьте уравнения реакций взаимодействия цинк гидроксида с калий гидроксидом в растворе и при сплавлении. Назовите продукты реакций.
2. Составьте уравнения реакций взаимодействия алюминий гидроксида: а) с хлоридной кислотой; б) барий гидроксидом при сплавлении; в) барий оксидом.
3. Составьте уравнения реакций образования калий алюмината K3AlO3 взаимодействием:
а) амфотерного гидроксида со щелочью; б) амфотерного оксида со щелочью; в) амфотерного гидроксида с основным оксидом; г) двух оксидов.
4. Кальций оксид и алюминий оксид внешне почти одинаковы. Как их можно различить, используя химические реакции?
5. Какие из данных веществ — KOH, FeCl3, H2SO4 — могут взаимодействовать: а) с натрий гидроксидом; б) купрум(іі) гидроксидом; в) цинк гидроксидом? Составьте соответствующие уравнения реакций.
6. С какими из указанных веществ взаимодействует натрий гидроксид: K2O, MgCO3, H3PO4, H2S, FeCl3, Fe(OH)2, AlCl3, Zn(OH)2, KCl, SO3? Составьте уравнения реакций и назовите продукты реакций.
7. Составьте уравнения реакций, которые соответствуют следующим превращениям:
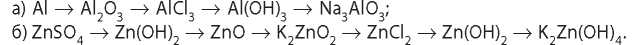
8. Вычислите массу барий гидроксида, который необходим для получения барий цинката массой 11,7 г из цинк оксида.
9. К раствору цинк сульфата массой 483 г с массовой долей соли 5 % добавили раствор натрий гидроксида до полного растворения осадка. Вычислите массу соединения Цинка.
10*. В дополнительных источниках найдите информацию об использовании соединений Алюминия для очистки воды. На каких свойствах этих соединений основан данный способ?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:49, Переглядів: 3571