§ 26. Молярный объем
Вспомните:
• газы отличаются от жидкостей и твердых веществ тем, что в них молекулы расположены на очень больших расстояниях, которые значительно превосходят размеры самых молекул;
• в газах молекулы движутся быстро и хаотически, благодаря чему газ расширяется и занимает весь доступный ему объем сосуда.
Закон Авогадро
В 1814 г., проводя многочисленные химические эксперименты с газообразными веществами, итальянский ученый Амедео Авогадро пришел к выводу, который сегодня называют законом Авогадро:
В равных объемах любых газов при одинаковых условиях (температура 1 и давление) содержится одинаковое число молекул.
На основании чего можно сделать такой вывод? Проводя реакцию между водородом и кислородом, Авогадро заметил, что объем водорода, вступающего в реакцию, всегда в два раза больше объема кислорода. По уравнению реакции
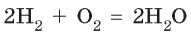
видно, что на одну молекулу кислорода в реакции расходуется две молекулы водорода. Таким образом, если молекул водорода реагирует в два раза больше, чем молекул кислорода, и объем водорода в два раза больше, чем объем кислорода, то в одинаковых объемах должно содержаться одинаковое число молекул.
В настоящее время это утверждение довольно легко объясняется. Как и большинство твердых и жидких веществ, газы состоят из отдельных молекул. Но, в отличие от твердых веществ и жидкостей, в которых молекулы расположены очень плотно друг к другу, в газах молекулы находятся на больших расстояниях. Эти расстояния значительно превышают размеры молекул. И хотя молекулы разных газов отличаются друг от друга размерами, формой и объемом, этими отличиями можно пренебречь и рассматривать их как крохотные твердые шарики.
Молекулы газа постоянно хаотически двигаются. Но среднее расстояние между молекулами постоянно и зависит только от условий, при которых находится газ. Если разные газы находятся при одинаковых условиях (температура и давление), то расстояния между молекулами примерно равны и поэтому одинаковое число молекул любых газов должно занимать равные объемы.
Молярный объем газов
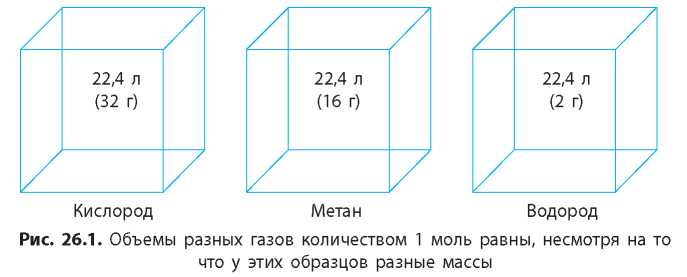
Зная, что один моль любого вещества содержит определенное число молекул, можно сделать вывод о том, что все газы количеством 1 моль при одинаковых условиях занимают одинаковый объем (рис. 26.1).
По аналогии с молярной массой объем одного моля вещества называют молярным объемом V :
m
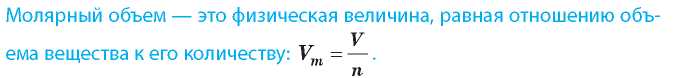
Молярный объем измеряют в литрах на моль (л/моль).
Значение молярного объема газов зависит от температуры и давления.
В химии принято приводить значение молярного объема при атмосферном давлении 760 мм рт. ст. (или 101 325 Па) и температуре 0 °С — такие условия называют нормальными (сокращенно н. у.).
При нормальных условиях молярный объем любого газа равен приблизительно 22,4 л/моль.
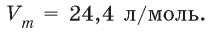
При комнатной температуре (25 °С) и атмосферном давлении (такие условия называют стандартными) молярный объем газов несколько больше:
Расчеты с использованием молярного объема
Зная молярный объем газа, можно определить количество вещества n, которое содержится в определенном объеме вещества V при нормальных условиях:
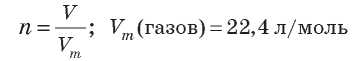
Газ, в котором расстояние между молекулами намного больше размеров молекул и в котором отсутствует межмолекулярное взаимодействие, называется идеальным газом. Состояние идеального газа описывается уравнением Менделеева-Клапейрона:
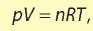
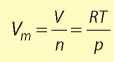
где p — давление, V — объем газа, n — количество вещества, R — универсальная газовая постоянная (8,314 Дж/моль ·K), T—температура по шкале Кельвина. Молярный объем идеального газа при любых условиях равен:
Подставляя в это уравнение значения температуры и давления для нормальных условий, получаем:
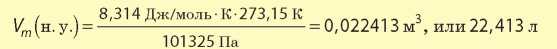
Необходимо также помнить, что 22,4 л/моль — это молярный объем идеального газа. Для реальных газов значения их молярных объемов будут несколько отличаться от значений для идеального газа. Так, при нормальных условиях Vm(H2) = 22,371 л/моль, а Vm(O2) = 22,425 л/моль. Это связано с тем, что водород и кислород — это реальные газы, для которых следует учитывать и объем молекул, и силы взаимодействия между ними. Однако отклонение реальных молярных объемов газов от молярного объема идеального газа незначительно и им можно пренебречь.
Молярный объем жидкостей и твердых веществ

Молярный объем жидких и твердых веществ, в отличие от молярного объема газов, почти не зависит от давления и температуры и разный для различных веществ. Это объясняется отличиями в строении твердых, жидких и газообразных веществ. В твердых и жидких веществах молекулы расположены очень плотно. Поэтому объем, занимающий 1 моль твердого или жидкого вещества, зависит от размеров молекул и плотности их расположения. Например, при комнатной температуре один моль воды занимает объем 18 мл, спирта — 58 мл, золота — 10 см3 (1 см3 = 1 мл).
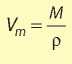
Молярный объем вещества в любом состоянии (твердом, жидком, газообразном) можно вычислить, если известны молярная масса М вещества и его плотность р:
Если мы знаем, что в одном моле вещества содержится число молекул, которое равное числу Авогадро, то можно вычислить число молекул газа в определенном объеме при нормальных условиях:
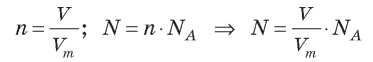
Зная количество газообразного вещества, можно вычислить его объем при нормальных условиях:
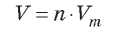
Задача 1. Вычислите объем, который занимает при нормальных условиях газ количеством 1,2 моль.
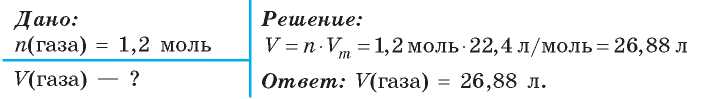
Задача 2. Вычислите количество вещества, содержащееся при нормальных условиях в газе объемом 5,6 л.

Задача 3. Вычислите число атомов Оксигена и число молекул кислорода, содержащихся в кислороде объемом 16,8 л (при н. у.).

Задача 4. Вычислите массу углекислого газа объемом 1 л (н. у.).

Лингвистическая задача
Это слово звучит почти одинаково на всех языках (даже на хинди, турецком и арабском). Придумал его в XVII в. голландский ученый Ян Баптист ван Гельмонт. Он взял его из латыни (chaos), в которую оно пришло из греческого языка. Греки словом хаос называли пустое туманное пространство, существовавшее еще до создания мира. Какое слово, по вашему мнению, имеется в виду? Как оно переводится на другие языки: украинский, английский, немецкий, французский?
В 1814 г., через три года после того как Авогадро опубликовал свой закон, появилась статья французского физика Ампера, где он сформулировал положения, очень близкие к закону Авогадро. Ампер позднее признал, что с трудом Авогадро ознакомился уже после публикации своей статьи, но на приоритете не настаивал. Поэтому в некоторых научных изданиях встречается словосочетание «закон Авогадро-Ампера».
Выводы
1. Согласно закону Авогадро, в одинаковых объемах любых газообразных веществ при одинаковых условиях содержится одинаковое число молекул этих веществ.
2. Следствием закона Авогадро является то, что любое газообразное вещество количеством 1 моль при нормальных условиях занимает объем, равный 22,4 л. Этот объем называют молярным объемом газов, его обозначают Vm, единица его измерения — л/моль.
1. Сформулируйте закон Авогадро.
2. Какие условия называют нормальными?
3. Чему равен молярный объем газа при нормальных условиях?
4. Объясните суть закона Авогадро по современным представлениям.
Задания для усвоения материала
1. Какой объем занимают при нормальных условиях: а) 2 моль азота; б) 0,5 моль кислорода; в) 0,25 моль фтора?
2. Сколько молекул содержится в резиновом шаре объемом 5,6 л (н. у.), заполненном водородом? Изменится ли ответ, если водород заменить: а) азотом; б) неизвестным газом; в) водопроводной водой?
3. Определите, какой объем при нормальных условиях занимают: а) 5 моль метана CH4; б) 2 моль сероводорода H2S; в) 4,2 моль аммиака NH3.
4. В каком объеме аммиака NH3 содержится в 3 раза больше молекул, чем в метане CH4 объемом 100 л (н. у.)?
5. Имеется два газа, взятые при нормальных условиях: 10 л метана CH4 и 20 л хлора Cl2. В каком из них содержится больше молекул, а в каком — больше атомов и во сколько раз?
6. Сколько молекул кислорода содержится при нормальных условиях:
а) в одном кубическом метре; б) в одном килограмме этого вещества?
7. Где содержится больше молекул аммиака — в 100 г или в 100 л (н. у.)?
8. Какой объем занимают при нормальных условиях: а) 10 г водорода;
б) 10 моль водорода?
9. В четырех одинаковых сосудах содержатся одинаковые массы таких газов: аммиак NH3, азот N2, сернистый газ SO2, кислород O2. В каком сосуде содержится больше всего молекул?
10. Сравните число молекул в 1 г аммиака NH3 и в 1 г азота. В каком случае и во сколько раз число молекул больше?
11. Вычислите массу сероводорода H2S объемом 11,2 л при нормальных условиях.
12. Масса 0,001 м3 газа (н. у.) равна 1,25 г. Вычислите массу одной молекулы этого газа.
13. Одинаковые ли массы и объемы (при одинаковых условиях) имеют 1,5 моль CO2 и 1,5 моль O2? Ответ подтвердите расчетами.
14. На вопрос: «Какой объем занимает 1 моль воды при нормальных условиях?» ученик ответил: 22,4 литра. Правильный ли этот ответ? Поясните.
15*. Каким образом с помощью закона Авогадро можно доказать, что: а) молекулы кислорода, азота, водорода состоят из двух атомов; б) состав молекулы воды — H2O, а не HO; в) состав молекулы аммиака — NH3, а не NH?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:39, Переглядів: 6077