§ 23. Строение твердых веществ и их свойства
Вспомните:
• в твердых веществах и жидкостях частицы (атомы и молекулы) расположены плотно друг к другу, в газах молекулы находятся на расстояниях, намного больших, чем размеры молекул;
• плавление и кипение — это физические процессы, они происходят без изменения химического состава веществ.
Кристаллические и аморфные вещества
Большинство окружающих нас веществ при обычных условиях находятся в твердом агрегатном состоянии. Твердые вещества разнообразны по физическим свойствам: они разного цвета, могут быть прочными или хрупкими, могут проводить электрический ток, плавиться при комнатной температуре или при очень высокой. Большинство физических свойств веществ обусловлены их внутренним строением.
По внутреннему строению и физическим свойствам различают два состояния твердых веществ — кристаллическое и аморфное.
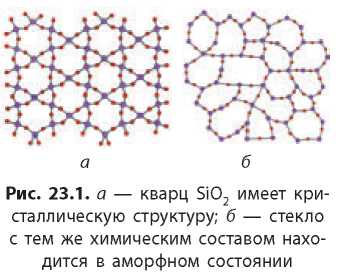
В кристаллических веществах частицы, из которых построены кристаллы, расположены в пространстве в определенном четком порядке. Если через центры этих частиц провести условные линии, то мы увидим некие четкие структуры, которые называют кристаллическими
решетками. Структурные единицы в кристаллических веществах образуют правильные геометрические фигуры (рис. 23.1а).
Кристаллические вещества:
• структурные единицы расположены в четком порядке
• имеют определенную температуру плавления
• образуют кристаллы четкой формы
Аморфные вещества:
• структурные единицы расположены хаотически
• плавятся в интервале температур
• при нагревании размягчаются
Аморфные вещества не имеют четкой пространственной структуры, а образованы из неупорядоченных частиц (атомов или молекул). По внутреннему строению они напоминают жидкости, только не могут течь (рис. 23.16). В отличие от кристаллических веществ, у которых есть определенная температура плавления, аморфные вещества плавятся в широком интервале температур. При нагревании они постепенно размягчаются и в конце концов становятся жидкими. Аморфным веществам, как и жидкостям, можно придать любую форму.
Примерами аморфных веществ являются стекло, смолы, янтарь, краски и клеи. Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состояниях, например сера, силиций(ГУ) оксид и др. Обычная природная сера образует желтые кристаллы, а при нагревании — аморфную смолообразную пластическую серу (рис. 23.2).

Твердые вещества имеют преимущественно кристаллическое строение. У каждого кристаллического вещества определенная, характерная для него форма кристаллов. Например, кристаллы поваренной соли NaCl имеют форму куба, калийной селитры KNO3 — форму призмы, алюминиевых квасцов KAl(SO4)2 — форму октаэдров и т. д. (рис. 23.3). Если кристаллическое вещество измельчить, то кристаллы распадаются на отдельные кусочки, каждый из которых сохраняет хотя бы частично форму исходного кристалла. Это свидетельствует о том, что кристаллическое состояние характеризуется упорядоченной структурой.
В зависимости от частиц, образующих кристалл, и от типа химической связи между ними различают такие типы кристаллических решеток: ионные, молекулярные, атомные (иногда их называют надмолекулярными), металлические.
Ионные вещества
Ионные вещества:
• в узлах решеток — ионы (катионы и анионы)
• тип связи — ионная
• твердые, хрупкие, нелетучие
• тугоплавкие
• некоторые растворяются в воде

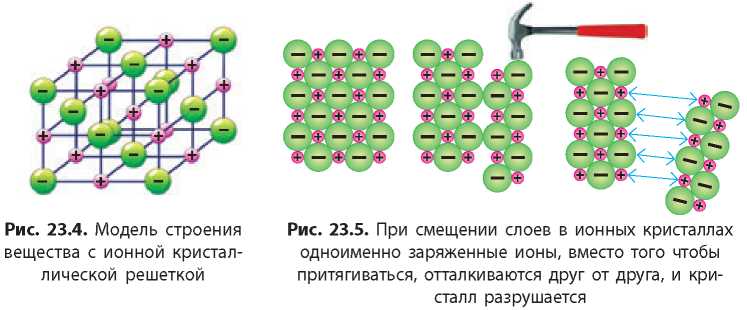
В узлах ионных кристаллических решеток расположены ионы. Разноименные ионы, из которых состоят ионные кристаллы, удерживаются вместе силами электростатического притяжения. Вокруг каждого иона в ионной кристаллической решетке расположено определенное количество других ионов (противоположных по знаку) (рис. 23.4). Ионные кристаллические решетки характерны для веществ с ионной связью.
В ионных кристаллах все ионы сильно притягиваются друг к другу. Для того чтобы сдвинуть ионы с места, необходимо большое количество энергии. Поэтому
ионные соединения при комнатной температуре твердые, а плавятся и кипят только при сильном нагревании (см. Приложение 1).
Вещества с ионными кристаллическими решетками нелетучие, поэтому у них нет запаха. Ионные кристаллы хрупкие: даже небольшой сдвиг слоев в кристалле приближает друг к другу одноименно заряженные ионы, отталкивание между которыми приводит к ослаблению притяжения и, как следствие, к появлению трещин в кристалле или даже к его разрушению (рис. 23.5).
В твердом состоянии ионные соединения не проводят электрический ток, поскольку все ионы прочно закреплены на определенном месте. Но если нагреть и расплавить такие вещества или растворить в воде, то все ионы становятся подвижными, поэтому расплавы и растворы ионных соединений хорошо проводят электрический ток.
Молекулярные вещества
Молекулярные
вещества:
• в узлах решеток — молекулы
• слабое межмолекулярное взаимодействие
• хрупкие, летучие
• легкоплавкие
• растворяются в воде или в других растворителях
В узлах молекулярных кристаллических решеток расположены молекулы, которые связаны между собой слабыми межмолекулярными силами. Например, лед состоит из молекул воды (рис. 23.6а, с. 116), а кристаллы йода состоят из двухатомных молекул йода I2 (рис. 23.6б, в, с. 116).
Молекулярные кристаллические решетки характерны для веществ только с ковалентными связями.
Отдельные молекулы, расположенные в узлах кристаллических решеток, удерживаются слабыми межмолекулярными

силами, которые значительно слабее, чем ковалентная связь в молекуле. Их легко разрушить, поэтому вещества с молекулярными решетками хрупкие и имеют невысокие температуры плавления и кипения. Многие вещества с молекулярными кристаллическими решетками при обычных условиях находятся в жидком или газообразном состоянии (хлор, хлороводород, кислород — газы; вода, сульфатная кислота, органические растворители — жидкости).
Некоторые молекулярные вещества при нагревании переходят из твердого в газообразное состояние, минуя жидкое (сублимируют), например йод, углекислый газ, нафталин.
Вещества с молекулярными решетками являются летучими, благодаря чему некоторые из них имеют характерный запах. Можно даже утверждать, что если у вещества есть запах, то оно имеет молекулярное строение.
Молекулярные вещества способны растворяться. Некоторые из них растворяются в воде, другие — в органических растворителях. Молекулы не содержат свободных носителей электрического заряда, поэтому ни в жидком, ни в твердом состоянии молекулярные вещества электрический ток обычно не проводят.
Вещества атомного строения
У атомных кристаллов решетки образованы из атомов, соединенных друг с другом прочными ковалентными связями. В таких структурах невозможно выделить структурную единицу, которую можно называть молекулой, каждый кристалл является одной большой «молекулой».
Чтобы разрушить ковалентные связи в атомных кристаллических решетках, необходимо большое количество энергии. Поэтому
Вещества атомного строения:
• в узлах решеток — отдельные атомы
• тип связи — ковалентный
• чрезвычайно твердые, нелетучие
• тугоплавкие
• не растворяются ни
в одном растворителе
у веществ с атомной кристаллической решеткой очень высокие температуры плавления и кипения. Они нерастворимы в воде и в других растворителях.
Сдвиг атома со своего места в кристалле приводит к разрушению ковалентной связи, а для этого необходимо много энергии. Поэтому вещества с атомной решеткой очень твердые, не пластичные и не хрупкие.
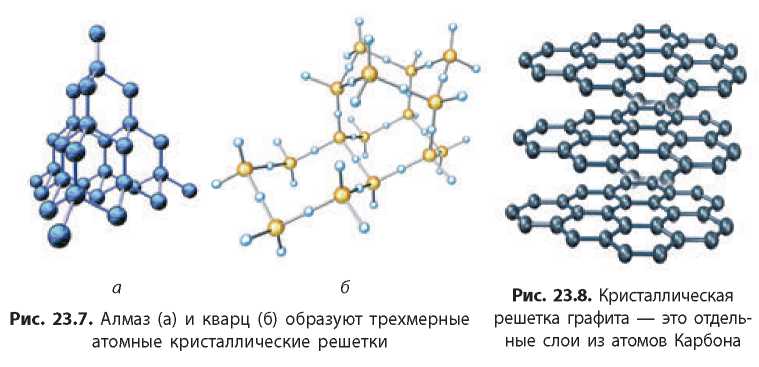
Классическим примером вещества с атомной кристаллической решеткой является алмаз — самое твердое вещество
среди всех известных (рис. 23.7а). Схожие решетки образуют атомы Силиция и Оксигена в кварце (рис. 23.7б).
У графита также атомная кристаллическая решетка, но, в отличие от алмаза и кварца, атомы Карбона в кристаллической решетке графита расположены слоями, которые слабо соединены друг с другом (рис. 23.8). Благодаря этому слои легко сдвинуть друг относительно друга, если приложить даже небольшое усилие. Этим объясняются «пишущие» свойства графита.
Форма кристаллов некоторых веществ настолько характерна, что по ней можно обнаруживать их в смеси. Так, например, в криминалистической химии по форме кристаллов идентифицируют некоторые яды и алкалоиды (наркотические вещества).
Греческое слово кристаллос, от которого происходят слова «кристалл» и «хрусталь», означает «лед». Оно происходит от греческого криос — «холод» или «мороз». Древние греки считали, что обычный лед, который находится в горах на сильном морозе, со временем каменеет и утрачивает способность таять. Античный философ Аристотель писал, что «кристалл рождается из воды, когда она полностью теряет теплоту». Таким образом, по мнению греков, горный хрусталь — это сильно замерзший лед.
Лингвистическая задача
На греческом дамасма означает «покорение, укрощение», дамао — «сокрушаю», соо ветственно адамас—«несокрушимый». А в переводе с французского brilliant означа< «блестящий». Благодаря каким свойствам известный минерал алмаз на многих язык; называют адамантом, а обработанный алмаз называют диамантом или бриллиантої На греческом аморфос означает «безобразный, бесформенный, некрасивый, позо| ный, мерзкий». Почему, по вашему мнению, аморфные вещества получили именн такое название?
Ознакомление с физическими свойствами веществ атомного, молекулярного и ионного строения
Оборудование: нагревательный прибор, штатив с пробирками, стаканы, шпатель, сосуд для нагревания (железная ложечка, большой шпатель или пробирки с пробиркодержателем), ступка с пестиком.
Реактивы: вода, сахар, калий сульфат (или другая соль, не образующая кристаллогидратов), силиций(ГУ) оксид.
Правила безопасности:
• используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза;
• нагревание проводите с использованием специальных держателей.
1. Изучение растворимости веществ в воде. В три стакана (пробирки) налейте воду высотой на ширину пальца. Шпателем поочередно внесите в воду выданные реактивы: сахар, калий сульфат и силиций(ГУ) оксид. Определите, растворяются ли вещества в воде.
2. Изучение плавления веществ. В железную ложечку (или пробирку) поместите небольшое количество сахара. Внесите ложку в пламя. Определите, способен ли сахар плавиться. Повторите опыт с калий сульфатом и силиций(ГУ) оксидом.
3. Изучение хрупкости веществ. Хрупкие вещества довольно легко измельчаются в ступке. Небольшое количество сахара поместите в ступку и попробуйте измельчить пестиком. Определите, может ли сахар измельчаться. Повторите опыт с калий сульфатом и силиций(^) оксидом.
4. Результаты исследований оформите в виде таблицы и сделайте вывод о типах кристаллических решеток исследуемых веществ.
|
Характеристика |
Сахар |
Калий сульфат |
Силиций(^) оксид |
|
Растворимость в воде |
|||
|
Способность плавиться |
|||
|
Хрупкость |
|||
|
Кристаллические решетки |
Изучение физических свойств веществ с разными типами кристаллических решеток: воды, поваренной соли, песка
Вам понадобятся: ложка с деревянной ручкой, нагревательный прибор (кухонная плита), стакан с водой, скалка (или небольшой молоточек), лед, поваренная соль, песок.
Правила безопасности:
• используйте небольшие количества веществ;
• при пользовании нагревательными приборами помните: горячие и холодные предметы выглядят одинаково.
Перед началом работы заморозьте в морозильной камере небольшое количество воды. Для этого можно использовать полиэтиленовые формочки для приготовления льда.
Для изучения растворимости веществ налейте в две чашки (стаканы) немного воды и поместите в них поваренную соль и песок. Сделайте вывод об их растворимости.
Для изучения плавления веществ небольшие порции льда, поваренной соли и песка поместите на ложку с деревянной ручкой и нагревайте. Сделайте вывод о способности веществ плавиться.
Для изучения хрупкости небольшой образец вещества поместите на деревянную доску и попробуйте растереть деревянной скалкой или растолочь молоточком на твердой поверхности. Изучите возможность измельчения льда, поваренной соли и песка.
Сделайте вывод о типах кристаллических решеток исследованных веществ.
Выводы
Физические свойства веществ обусловлены типом химической связи и типом их кристаллических решеток:
|
Характеристи- |
Тип кристаллических решеток |
||
|
ка веществ |
Ионные |
Молекулярные |
Атомные |
|
Тип связи |
Ионная |
Ковалентная (в молекулах) и слабое межмолекулярное взаимодействие |
Ковалентная |
|
Тип частиц в узлах решеток |
Разноименно заряженные ионы |
Молекулы веществ, слабо взаимодействующие между собой |
Атомы, прочно соединенные друг с другом |
|
Температуры плавления и кипения |
Высокие |
Низкие |
Очень высокие |
|
Агрегатное состояние при обычных условиях |
Твердые |
Газы, жидкости или легкоплавкие твердые |
Твердые |
|
Летучесть |
Нелетучие |
Летучие |
Нелетучие |
|
Твердость, пластичность |
Твердые, хрупкие, непластичные |
Хрупкие, непластичные |
Очень твердые, непластичные, нехрупкие |
|
Способность проводить электрический ток |
В твердом состоянии не проводят, а расплавы и растворы — проводят |
В твердом состоянии не проводят |
Большинство не проводят, некоторые являются проводниками (графит) или полупроводниками (германий) |
|
Растворимость |
Большинство растворяются в воде |
Растворяются в воде или в других растворителях |
Не растворяются ни в воде, ни в других растворителях |
Контрольные вопросы
1. Назовите общие свойства твердых веществ.
2. Чем отличаются кристаллические вещества от аморфных? Приведите примеры кристаллических и аморфных веществ.
3. Что означает термин «кристаллическая решетка»?
4. Какие типы кристаллических решеток существуют?
5. Какие физические свойства характерны для веществ с кристаллическими решетками: а) ионной; б) молекулярной; в) атомной?
6. Какими взаимодействиями удерживаются: а) атомы в молекуле; б) молекулы в молекулярном кристалле; в) ионы в ионном кристалле; г) атомы в атомном кристалле?
Задания для усвоения материала
1. Приведите по одному примеру твердых веществ, которые при нагревании: а) разлагаются; б) плавятся; в) сублимируют.
2. Определите степень окисления и валентность Карбона в алмазе и графите.
3. Объясните, почему кварц SiO2 и углекислый газ CO2 имеют совершенно разные физические свойства, несмотря на сходный состав.
4. Из данного перечня выпишите отдельно формулы веществ с кристаллическими решетками: а) атомными; б) ионными; в) молекулярными. CaBr2, O2 (тв.), CuO, Br2 (тв.), NaNO3, HCl (тв.), Fe2(SO4)3, CO2 (тв.), H2O (тв.).
5. Почему пластинка из силиция или германия от сильного удара разлетается на куски, а из олова или свинца — только деформируется? Объясните, в каком случае и почему разрушаются химические связи.
6. Белый фосфор плавится при 44 °С, а красный фосфор — при значительно более высокой температуре. Какой вывод можно сделать о типах их кристаллических решеток?
7. Карборунд (силиций карбид SiO) плавится при 2830 °С, по твердости он близок к алмазу. Каков тип его кристаллической решетки?
8. Ванилин — бесцветное кристаллическое вещество с приятным запахом. Какая у него кристаллическая решетка?
9. Некоторое бесцветное вещество хорошо растворяется в воде, у него высокая температура плавления. Сделайте предположение о типе его кристаллической решетки. Есть ли у этого вещества запах?
10. Выполните учебный проект № 3 «Зависимость физических свойств веществ от типов кристаллических решеток».
11*. Используя текст параграфа, проиллюстрируйте взаимосвязь между составом и физическими свойствами веществ. Поясните логическую цепь: химический состав ^ химическая связь ^ кристаллическая решетка ^ физические свойства.
12*. Найдите в дополнительных источниках информацию о распространенных аморфных соединениях, в частности стекле, янтаре и битуме. Как влияют методы получения этих веществ на окружающую среду?
Проверьте свои знания по теме «Химическая связь и строение вещества».
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:37, Переглядів: 4104