§ 20. Ионная связь
Вспомните: щелочные элементы — это элементы ІА группы, галогены — элементы VI^ группы.
Образование веществ с ионной связью
Механизм образования веществ с ионной связью имеет общие черты с образованием веществ с ковалентной связью. Они также образуются благодаря перераспределению электронов. Ионная связь существует в веществах, образованных металлическими и неметаллическими элементами.
Атомы металлических элементов отдают электроны, превращаясь в положительно заряженные ионы (катионы), а атомы неметаллических — принимают электроны, превращаясь в отрицательно заряженные ионы (анионы). Между этими разноименно заряженными ионами возникает электростатическое притяжение, сила которого зависит от зарядов ионов и их радиусов. Такую связь называют ионной.
Химическую связь, возникающую в результате притяжения противоположно заряженных ионов, называют ионной.
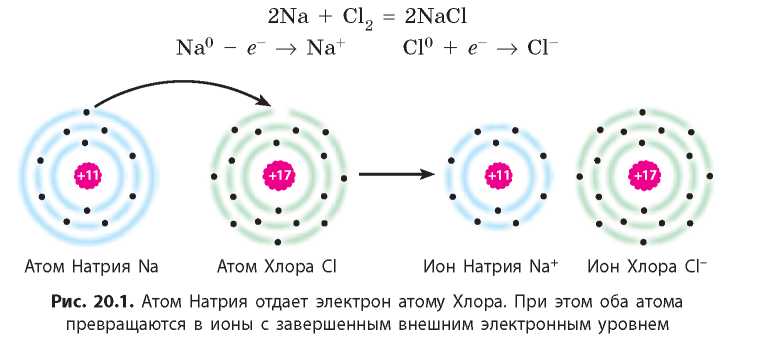
В результате химической реакции натрия и хлора образуются ионы Натрия Na+ и хлорид-ионы Cl- (рис. 20.1):
Ионная связь:

• возникает между противоположно заряженными ионами
• существует между ионами металлических и неметаллических элементов
Продукт взаимодействия — натрий хлорид — полностью состоит из ионов Натрия и хлорид-ионов, образованных перемещением электронов от атомов Натрия к атомам Хлора. Ионы в кристалле между собой не связаны жестко, т. е. между ними не существует общих электронных пар. В натрий хлориде они удерживаются вместе благодаря притяжению между противоположно заряженными ионами (рис. 20.2).
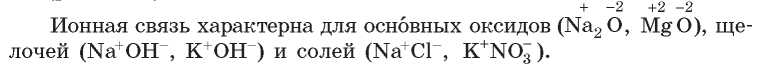
Катионы и анионы могут состоять не только из одного, но и из нескольких атомов. Например, щелочи образованы катионами металлов M+ и гидроксид-ионами OH-. Связь между катионами металлических элементов M+ и гидроксид-ионами OH- ионная, а между атомами Гидрогена и Оксигена в ионе OH- — ковалентная полярная.
Критерий образования ионной связи
Образование веществ с ионной связью можно рассматривать и с точки зрения образования общей электронной пары:
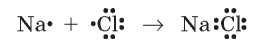
Но Натрий и Хлор значительно отличаются по электроотрицательности, и атом Хлора настолько сильнее притягивал бы общую электронную пару, что она полностью перешла бы к нему, а атому Натрия уже не принадлежала бы. Поэтому электрон, который находился на внешнем уровне атома Натрия и должен был образовать общую электронную пару, сразу переходит в полную собственность атома Хлора с одновременным превращением этих атомов в ионы.
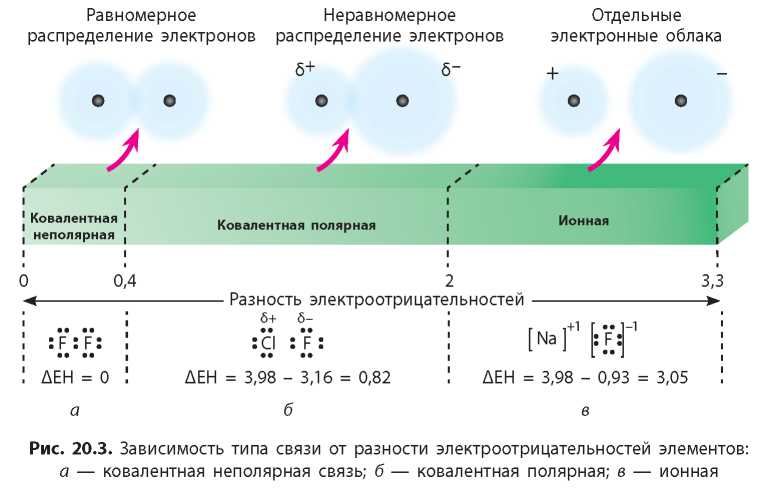
Итак, ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда общая электронная пара полностью перешла к одному из атомов. Ионная связь существует между атомами элементов со значительной разностью между значениями их электроотрицательностей.
Между атомами одного неметаллического элемента, конечно, существует ковалентная неполярная связь (рис. 20.3а). (Иногда неполярной также считают связь между атомами разных неметаллических элементов при условии, что разность между электроотрицательностями элементов ^EH) не превышает 0,4.) Если же ΔEH меньше 2, то связь считают ковалентной полярной (рис. 20.36). Условно считают, что связь ионная, если ΔEH больше 2 (рис. 20.3е).
Лингвистическая задача
В переводе с греческого ката означает «вниз», ана — «вверх», ион — «идущий». Что, по вашему мнению, означают термины «катион» и «анион»?
Выводы
1. Ионная связь существует в веществах, образованных элементами с большой разностью электроотрицательностей. При взаимодействии веществ, образованных такими элементами, происходит полная переда-
ча электронов от атомов металлических элементов атомам неметаллических элементов с образованием противоположно заряженных ионов.
2. Вещества с ионной связью существуют в виде кристаллов, в которых положительно заряженные ионы окружены определенным числом отрицательно заряженных ионов, и наоборот. Ионная связь реализуется благодаря электростатическому притяжению противоположно заряженных ионов.
Контрольные вопросы
1. Какую связь называют ионной? Приведите примеры соединений с ионной связью.
2. Как можно отличить ионную связь от ковалентной полярной?
3. Сформулируйте два отличия ионной связи от ковалентной.
Задания для усвоения материала
1. Чем принципиально отличается ковалентная связь от ионной?
2. Приведите по две формулы соединений, в которых Оксиген образует связь: а) ионную; б) ковалентную.
3. Выпишите из представленного перечня отдельно формулы соединений, в которых химическая связь: а) ковалентная неполярная; б) ковалентная полярная; в) ионная.
H2, HBr, Na2O, CaO, CO2, CO, O2, NO2, K3N, NH3, N2, NF3, F2, OF2, MgF2.
4. Изобразите схему образования ионов на примере: а) калий флуорида KF; б) магний оксида MgO; в) алюминий бромида AlBr3.
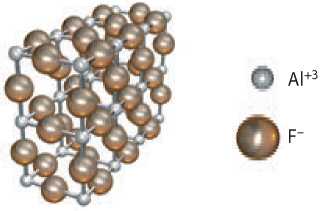
5. На рисунке изображена модель кристалла алюминий флуорида. Определите, сколько ионов окружает каждый ион Алюминия и ион Флуора.
6. Объясните, почему знание значения электроотрицательности элементов соединенных атомов позволяет сделать вывод о типе химической связи между ними.
7*. Понятие «валентность» некорректно применять для элементов в составе ионных соединений. Как вы считаете, какие принципиальные отличия веществ с ковалентной и ионной связью предопределяют такую некорректность?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:36, Переглядів: 3497