§ 9. Атом: ядро плюс электроны
Открытие сложного строения атомов
Вам уже известно, что все вещества состоят из атомов, молекул или ионов. В свою очередь, молекулы и ионы образованы из атомов.
Долгое время считалось, что атом невозможно разделить на более мелкие частицы. До начала XX в. была известна только одна количественная характеристика атомов — относительная атомная масса, которая была взята за основу классификации химических элементов. Но, используя только массу атомов, нельзя было объяснить причины периодичности изменения их свойств. Было непонятно, почему атомы с близкими массами, например Алюминий и Силиций, существенно отличаются по свойствам, тогда как атомы с разными массами обладают сходными свойствами. Таким образом, для характеристики атомов знания одной лишь их массы недостаточно. Все это наводило ученых на мысль о том, что атом имеет сложное строение. В начале XX в. было выдвинуто множество гипотез и моделей строения атома, некоторые из которых представлены на рисунке 9.1.
Наибольших успехов в исследовании атома достиг английский ученый Эрнест Резерфорд. В 1909 г. он провел эксперимент, в котором бомбардировал золотую фольгу положительно заряженными альфа-частицами. Большинство из них, проходя сквозь фольгу, не отклонялись от начального направления, некоторые незначительно отклонялись, а небольшое число альфа-частиц существенно отклонялись от первоначальной траектории и иногда даже летели в обратном направлении. Резерфорд писал, что это было так удивительно, как
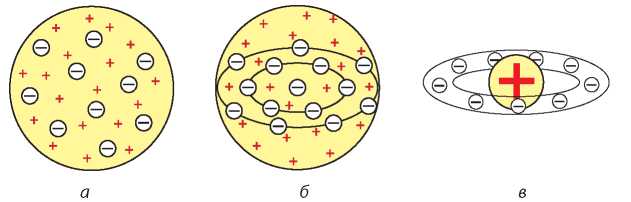
Рис. 9.1. а — «кексовая» модель атома Уильяма Томсона (1902), который представлял атом сгустком положительно заряженной материи, где равномерно распределены электроны, как изюм в кексе; б — «кексовая» модель, усовершенствованная Джозефом Джоном Томпсоном (1904), в которой электроны расположены в одной плоскости и образуют концентрические кольца; в — модель атома Хантаро Нагаока (1904), предположившего, что атом похож на планету Сатурн — половину объема занимает положительно заряженный шар, вокруг которого спутники-электроны образуют кольцо
Английский физик, лауреат Нобелевской премии по химии 1908 г. Является основателем нового направления науки — ядерной физики. Он создал учение о радиоактивности и строении атома. Предложил новую, революционную для того времени теорию строения атома, которая сегодня является общепризнанной. Этим он опроверг мнение о неделимости атома и ошеломил весь мир идеей, что все тела (даже самые твердые) преимущественно являются пустым пространством, в котором движутся крохотные частицы. Осуществил первую искусственную ядерную реакцию и продемонстрировал возможности использования ядерной энергии. Предсказал существование нейтрона.

будто вы выстреливаете из пушки в лист бумаги, а пушечное ядро отталкивается от него и летит назад вам в лоб.
Результаты этого эксперимента противоречили популярным в то время моделям атомов. Если бы «кексовая» модель атома соответствовала действительности, то альфа-частицы должны были бы свободно проходить сквозь атомы золотой фольги (рис. 9.2). Поскольку альфа-частицы заряжены положительно, то для того чтобы отражаться от фольги, они должны сталкиваться с другими положительно заряженными частицами в составе атомов, образующих золотую фольгу. Основываясь на результатах своего эксперимента, Резерфорд доказал, что положительный заряд в атоме сконцентрирован в центре атома в очень небольшом объеме, который он назвал
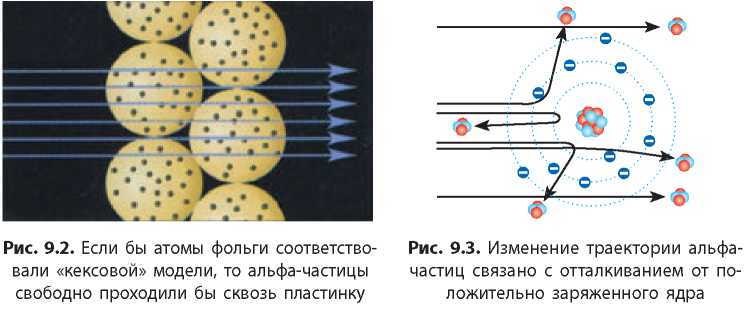
ядром. В ходе эксперимента чем ближе к ядру пролетали альфа-частицы, тем сильнее искривлялась их траектория, а частицы, попавшие прямо в ядро, отталкивались от него и летели назад (рис. 9.3).
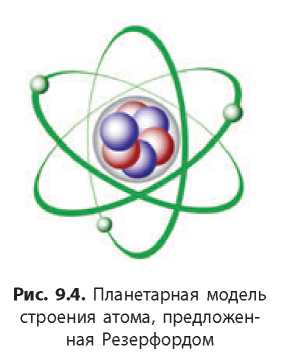
Резерфорд предложил планетарную модель строения атома, которой с небольшими изменениями мы пользуемся и сегодня (рис. 9.4). Согласно этой модели, весь положительный заряд атома сосредоточен в центре — ядре, которое окружено отрицательно заряженными электронами. Электроны движутся вокруг ядра по определенным орбитам, как планеты вокруг Солнца.
Атом — это электронейтральная химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Модель атома Резерфорда, без сомнения, лучше всех остальных отображала истинное строение атома, но и она имела существенное противоречие: по известным тогда законам физики электрон, если он вращается вокруг ядра, должен непрерывно излучать энергию и со временем упасть на ядро. Модель атома Резерфорда усовершенствовал датский физик Нильс Бор. Он утверждал, что электроны могут вращаться не на любой орбите, а только на определенных расстояниях от ядра, образуя концентрические сферы из электронов. Поэтому иногда планетарную модель атома называют моделью Бора-Резерфорда.
Состав атомов
Итак, атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов.
Заряд электрона называют элементарным, так как он наименьший из всех известных зарядов и потому его абсолютную величину принимают за условную единицу измерения. Именно в этих условных единицах обычно указывают заряды всех частиц: электронов, протонов, ядер, ионов и т. д. Заряд самого электрона принимают за -1.
Электрон — самая легкая из известных элементарных частиц. Его масса составляет 9,1 · 10-28 г, это в 1837 раз меньше массы самого легкого из атомов — атома Гидрогена. Часто в расчетах массой электрона пренебрегают (считают равной нулю).
Таблица 5. Частицы, из которых состоит атом
|
Частица |
Обозначе ние |
Заряд, усл. ед. |
Масса |
Массовое число |
|
|
г |
а. е. м. |
||||
 |
в~ |
-1 |
9,1094 · 10-28 |
0,00055 |
0 |
 |
p |
+ 1 |
1,6726 · 10-24 |
1,00728 |
1 |
 |
n |
0 |
1,6750 · 10-24 |
1,00867 |
1 |
После открытия сложного строения атома выяснили, что ядро атома также имеет сложное строение. Оно состоит из частиц двух видов — протонов и нейтронов (рис. 9.5). Протоны и нейтроны называют нуклонами. Протоны являются положительно заряженными частицами с зарядом +1, а нейтроны не имеют заряда (табл. 5). Это означает, что весь положительный заряд ядра образован только протонами — их число равно заряду ядра:
|
число протонов в ядре = заряд ядра |
Любой атом является электронейтральным, следовательно, число !ротонов с зарядом +1 всегда равно числу электронов с зарядом -1:
|
число протонов в ядре = число электронов в электронной оболочке |
Ядро — самая тяжелая часть атома: его масса составляет около 99,97 % от массы атома и определяется числом протонов и нейтронов в ядре. Массы протона и нейтрона почти одинаковы и приблизительно равны 1 а. е. м. Таким образом,
|
относительная атомная масса = массовое число = = число протонов + число нейтронов |
Пример. Ядро атома содержит 5 протонов и 5 нейтронов.
1. Определим заряд ядра и число электронов в атоме:
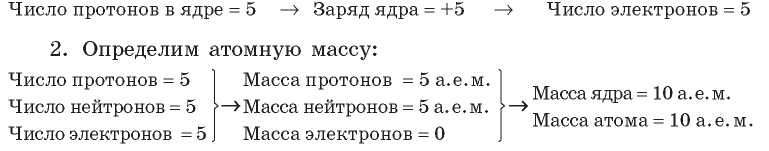
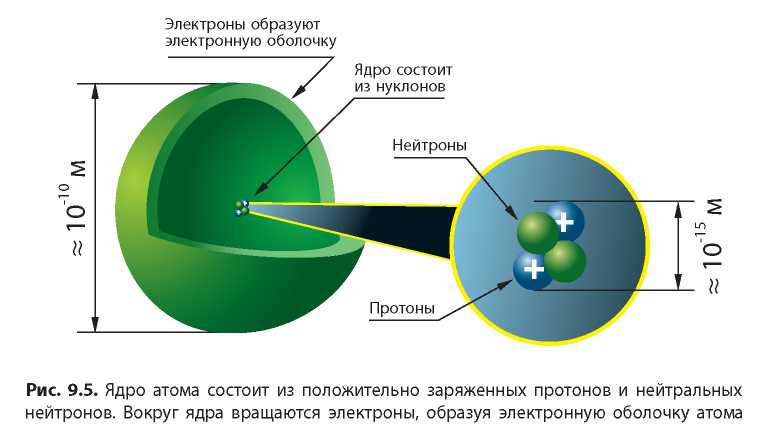
И хотя именно в ядре сосредоточена вся масса атома, тем не менее размеры ядра чрезвычайно малы: его радиус приблизительно в сто тысяч раз меньше радиуса атома (рис. 9.5). Представьте, если размер ядра увеличить до размера яблока, то сам атом будет размером с земной шар.
Порядковый номер химического элемента
У всех атомов одного химического элемента число протонов всегда одинаковое (и равно заряду ядра), а число нейтронов может быть разным, поэтому масса атомов одного элемента также может отличаться. Это означает, что не масса, а именно заряд ядра является основной характеристикой, отличающей атомы одного вида от атомов другого вида. Именно поэтому в начале XX в. изменилось определение понятия химического элемента:
Химический элемент — это разновидность атомов с одинаковым зарядом ядра.
После открытия сложного строения атома была изменена и формулировка Периодического закона:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Дальнейшее изучение строения атома показало, что протонов в атомах содержится не произвольное число, а равное порядковому номеру химического элемента в Периодической системе химических элементов Д. И. Менделеева. Следовательно, и заряд ядра также равен порядковому номеру:
|
число протонов в ядре = заряд ядра = порядковый номер элемента |
Оказалось, что, даже не догадываясь о сложном строении атомов, Менделеев при составлении своей Периодической системы расположил элементы в порядке возрастания зарядов их атомных ядер.
• Физики уверены, что протоны, нейтроны и другие частицы состоят из кварков — подлинно элементарных частиц. Однако ученым никак не удается выделить кварки и таким образом подтвердить их существование. Но электрон до сих пор считается элементарной частицей.
• Эрнест Резерфорд проводил исследования в основном в области физики и однажды заявил, что все науки можно разделить на две группы — на физику и коллекционирование марок. Однако Нобелевскую премию Резерфорд получил именно по химии. Позднее он отметил, что из всех превращений, которые ему удалось наблюдать, самым быстрым оказалось его собственное превращение из физика в химика.
Выводы
1. Общепринятой является планетарная модель строения атомов, согласно которой атом состоит из положительно заряженного ядра, вокруг которого на определенном расстоянии вращаются отрицательно заряженные электроны, образуя электронную оболочку атома.
2. Ядро атома состоит из нуклонов: положительно заряженных протонов и нейтральных нейтронов. Число протонов в ядре определенного атома равно порядковому номеру химического элемента в Периодической системе. Поскольку атом электронейтрален, то число протонов в ядре атома равно числу электронов в его электронной оболочке.
Контрольные вопросы
1. Охарактеризуйте планетарную модель атома Резерфорда.
2. Какие частицы входят в состав: а) атома; б) атомного ядра? Каковы их заряд и масса?
3. Ядро атома: а) имеет отрицательный заряд; б) имеет положительный заряд; в) не имеет заряда.
4. Какие характеристики атома вам известны?
5. Как определить число протонов в ядре атома: а) по порядковому номеру элемента в Периодической системе; б) по номеру периода; в) по номеру группы?
6. Дайте определение понятиям «атом» и «химический элемент».
7. Приведите современную формулировку Периодического закона. Чем она отличается от той, которую вы изучали ранее?
Задания для усвоения материала
1. Ядро атома Гелия имеет заряд +2. Сколько электронов в атоме Гелия?
2. Атом Карбона содержит 6 электронов. Чему равен заряд: а) атома Карбона; б) ядра атома Карбона?
3. Определите число протонов в ядрах и заряды атомов: а) Лития; б) Сульфура; в) Феррума; г) Плюмбума.
4. Определите заряд ядра, число электронов и массу атома, если ядро содержит: а) 8 протонов и 9 нейтронов; б) 25 протонов и 30 нейтронов; в) 89 протонов и 117 нейтронов. Назовите соответствующие химические элементы.
5*. Опишите суть эксперимента Резерфорда по установлению строения атома. Какие результаты опыта позволили ему сделать выводы о планетарном строении атома?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:26, Переглядів: 3156