§ 10. Нуклиды. Изотопы
Вспомните:
• характеристики частиц, из которых состоят атомы (табл. 5);
• атомная единица массы — единица измерения масс атомов, она равна 1/12 массы атома Карбона.
Понятие о нуклидах
Как вы уже знаете, ядра атомов состоят из протонов и нейтронов.
Ядра разных атомов могут содержать разное или одинаковое число протонов и нейтронов. Например, на рисунке 10.1 на с. 50 изображены модели четырех атомов. В ядрах этих атомов содержится по три или четыре протона и нейтрона. Но мы видим, что ядра атомов А и В имеют одинаковый состав: они содержат по три протона и три нейтрона. Ядро атома Б также содержит три протона, но в нем четыре нейтрона. Хотя в ядре атома Г также семь частиц, как у атома Б, но распределение по протонам и нейтронам иное.
Итак, на рисунке 10.1 изображены три разновидности атомов. Каждую такую разновидность атомов называют нуклидом. Вы видите,
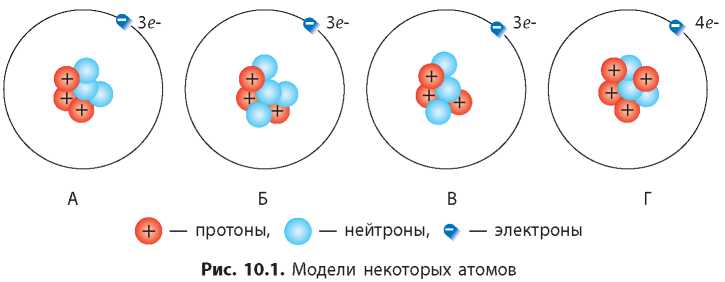
что атомы А и В — это атомы одного нуклида, атомы Б — второго, а атомы Г — третьего.
Нуклид — это разновидность атомов с определенным числом протонов и нейтронов в ядре.
Каждый нуклид характеризуют определенными числами: протонное число Z указывает число протонов в ядре атома данного нуклида;
нейтронное число N указывает число нейтронов; массовое число, или нуклонное число, А — это число нуклонов, оно равно сумме протонного и нейтронного чисел:
|
массовое число = протонное число + нейтронное число A = Z + N |
Поскольку массы протона и нейтрона равны приблизительно 1 а. е. м., а масса электрона мизерная, то массовое число атома приблизительно равно его относительной атомной массе, округленной до целого числа.
Обозначение нуклидов
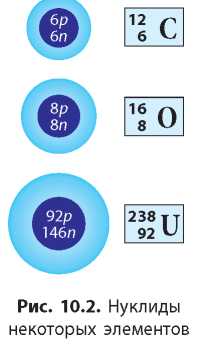
В науке используют специальные обозначения нуклидов: заряд ядра, т. е. протонное число, пишут слева внизу от символа химического элемента, а массовое число — слева вверху (рис. 10.2).
Например, для нуклида Оксигена:

Иногда протонное число опускают и пишут просто 15O, поскольку и так известно, что у всех нуклидов Оксигена протонное число равно 8.
Нуклиды можно обозначать как химическими символами, так и с использованием названий химических элементов, например: Оксиген-15,
Оксиген-18.
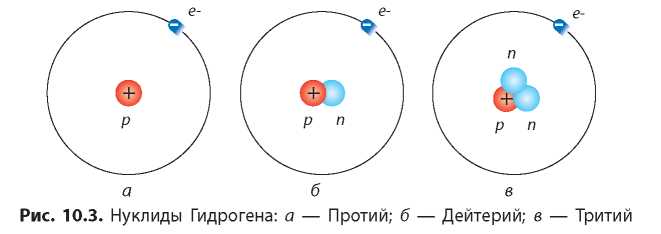
Нуклиды единственного элемента — Гидрогена — кроме таких обозначений еще имеют собственные названия: обычный Гидроген H (Jh ) —
Протий, ядра его атомов состоят только из одного протона (рис. 10.3а); тяжелый Гидроген D (ІН) — Дейтерий, в ядрах его атомов кроме одного протона имеется еще один нейтрон (рис. 10.36); сверхтяжелый Гидроген Т (^H) — Тритий, в ядрах атомов которого кроме одного протона имеется два нейтрона (рис. 10.3е). Ученым удалось получить еще суперсверхтяжелый Гидроген 1н, но собственного названия у него пока нет.
Зная порядковый номер элемента и массовое число нуклида, легко вычислить, сколько электронов, протонов и нейтронов содержит этот атом:
• число электронов равно числу протонов Z, которое совпадает с порядковым номером (зарядом ядра);
• число нейтронов N равно разности между массовым числом А и зарядом ядра: N = A - Z.
Пример. Сколько протонов, нейтронов и электронов содержится в нуклиде Плюмбум-210?
Решение:
Массовое число этого нуклида Плюмбума равно 210. Так как порядковый номер Плюмбума — 82, то в атоме нуклида Плюмбума-210 содержится 82 протона и 82 электрона. Число нейтронов вычислим как разность между массовым числом и числом протонов:
N = 210 - 82 = 128.
Ответ: 82 протона, 128 нейтронов, 82 электрона.
Понятие об изотопах
Мы уже выяснили, что ядра атомов одного химического элемента содержат одинаковое число протонов, которое равно порядковому номеру этого элемента в Периодической системе. Но если протонов в ядрах данного элемента должно содержаться строго определенное число, то число нейтронов в ядре может быть разным, поскольку это не влияет на заряд ядра, а только на его массу.
На рисунке 10.1 на с. 50 изображены модели некоторых атомов. И хотя атомы А и Б являются атомами разных нуклидов, в их ядрах одинаковое число протонов (по три). Таким образом, эти нуклиды представляют один и тот же химический элемент: они проявляют одинаковые химические свойства, но обладают разной массой.
Все нуклиды, имеющие одинаковый заряд (протонное число) и разное нейтронное число, называют изотопами (рис. 10.4). Поскольку нуклиды с одинаковым протонным числом относятся к одному химическому элементу, то:
Изотопы — это разные нуклиды одного химического элемента.
Например, в ядре атомов Оксигена содержится 8 протонов (порядковый номер Оксигена в Периодической системе — 8). А число
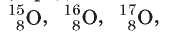
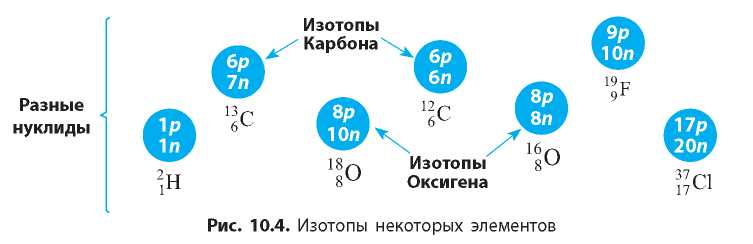
нейтронов может быть 7, 8, 9 и даже 10. Следовательно, среди атомов Оксигена можно выделить четыре разных нуклида:
1^O. Но все эти нуклиды являются изотопами.
Нуклиды в природе
Всего известно более 2000 нуклидов. Поскольку химических элементов в настоящее время насчитывается 118, то большинство этих нуклидов являются изотопами, и можно предположить, что в среднем на каждый элемент приходится около 10 нуклидов. Но, безусловно, каждый химический элемент имеет разное число нуклидов.
Рекордсмены по числу нуклидов — Ксенон и Цезий: каждый из них существует в виде 36 нуклидов, большинство из которых нестабильны.
У большинства химических элементов имеются природные нуклиды, т. е. те, что встречаются в природных телах. Таких нуклидов существует около 300. Остальные нуклиды получены искусственно.
В природе элементы обычно существуют в виде смеси нескольких нуклидов, например Карбон (12C, 13C и 14C), Нитроген (14N и 15N). Рекордсменом по числу природных нуклидов (10) является Станнум. А некоторые химические элементы имеют лишь один природный нуклид, например Флуор (19F), Натрий (23Na), Фосфор (31P).
Вы, наверное, заметили, что значения относительных атомных масс элементов, приведенные в Периодической системе, не целые числа: Ar(C) = 12,011, Ar(Cl) = 35,453, а массовые числа всех нуклидов — целые числа. Это связано с тем, что большинство элементов встречается в природе в виде нескольких нуклидов, и значение, приведенное в таблице, является средним, вычисленным с учетом содержания каждого нуклида. Так, природный Хлор на 75 % состоит из атомов 35Cl и на 25 % — из 37Cl, поэтому его относительная атомная масса равна 35,5.
• Все нуклиды разделяют на стабильные и нестабильные. Стабильные нуклиды существуют бесконечно долго. Большинство окружающих нас атомов относятся именно к стабильным нуклидам.
• Химические элементы, не имеющие стабильных нуклидов, называют радиоактивными. К ним относятся все элементы, расположенные в Периодической системе за Бисмутом, а также Технеций и Прометий. Большинство радиоактивных элементов получено искусственно и в природе не встречаются. В Периодической системе вместо относительной атомной массы для радиоактивных элементов указывают массовые числа самых стабильных из их нуклидов.
• О сложном строении ядра атома узнали в начале ХХ в., но впервые искусственно расщепить ядро атома удалось только в 1932 г. ученым А. К. Вальтеру, Г. Д. Латышеву, А. И. Лейпунскому, К. Д. Синельникову из Харьковского физико-технического института. В 2016 г. на базе этого института была открыта ядерная установка «Источник нейтронов», которая позволит получать до 50 радиоактивных нуклидов для диагностики многих заболеваний, в частности рака. Сегодня украинские ученые из научных учреждений Киева, Львова и Харькова являются членами международной научной группы, изучающей теорию строения элементарных частиц на Большом адронном коллайдере.
Лингвистическая задача
На греческом языке изос означает «равный, одинаковый, подобный», а топос — «место». Что, по вашему мнению, означает термин «изотоп»?
На латыни nucleos означает «ядро», а eidos — «разновидность». Зная это, объяснит определение термина «нуклид».
• Радиоактивный химический элемент Астат — самый редкий элемент из всех, что встречаются в природе. Если собрать весь Астат в земной коре, то получим не больше одного грамма.
• Радиоактивный радон используют в медицинской практике, в частности для лечения злокачественных опухолей.
Выводы
. 1. Разновидность атомов с определенным числом протонов и нейтронов называют нуклидом. Если нуклиды содержат одинаковое число протонов, т. е. являются нуклидами одного химического элемента, то такие нуклиды называют изотопами. Разные нуклиды обозначают, указывая массовое число рядом с символом элемента, а нуклиды Гидрогена имеют собственные названия: Протий, Дейтерий, Тритий.
2. Каждый нуклид описывают определенными числами: протонное число Z — число протонов в ядре, нейтронное число N — число нейтронов в ядре, массовое число A — нуклонное число, равное сумме протонного и нейтронного чисел.
3. Каждый элемент может существовать в виде нескольких нуклидов. Нуклиды, встречающиеся в природе, называют природными. Нуклиды, которые могут существовать бесконечно долго, называют стабильными, а нуклиды, которые со временем подвергаются радиоактивному распаду, — радиоактивными.
Контрольные вопросы
1. Дайте определения понятий «нуклид» и «изотоп».
2. Чем отличаются стабильные и нестабильные нуклиды? Приведите примеры стабильных и нестабильных нуклидов.
3. Изотопы отличаются друг от друга: а) числом протонов; б) числом нейтронов; в) числом электронов.
4. Как определить число протонов, нейтронов и электронов в атоме?
5. Назовите изотопы Гидрогена. Чем они отличаются?
Задания для усвоения материала
1. Ядро атома химического элемента содержит два протона и один нейтрон. Запишите обозначение этого атома: укажите химический символ, порядковый номер и массовое число.
2. Сколько протонов и нейтронов содержат ядра 7O, 14C, 137Cs?
3. Чем отличается состав ядер атомов нуклидов: а) Лития 6Li и 7Li; б) Урана 235U и 239U?
4. Какой нуклид Натрия содержит такое же число нейтронов, что и нуклид 24Mg?
5. Назовите элементы, ядра атомов которых содержат: а) 2 протона и 2 нейтрона; б) 15 протонов и 16 нейтронов; в) 35 протонов и 45 нейтронов. Напишите обозначения этих нуклидов.
6. Из данного перечня выберите: а) изотопы; б) нуклиды с одинаковым нейтронным числом; в) нуклиды с одинаковым нуклонным числом.
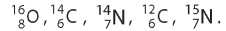
Сколько разных видов молекул воды может быть образовано из трех нуклидов Гидрогена и трех нуклидов Оксигена?
Относительная атомная масса Бора составляет 10,81. Как вы считаете, в виде каких нуклидов существует Бор в природе?
Нестабильные нуклиды подвержены радиоактивному распаду, вследствие чего возникает радиоактивное излучение. В дополнительных источниках найдите информацию о видах радиоактивного излучения и их влиянии на живые организмы.
В дополнительных источниках информации найдите примеры использования ядерных реакций в разных областях человеческой деятельности. На каких процессах они основываются? Как влияют на окружающую среду? Каким образом можно обеспечить защиту от радиоактивного облучения?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:27, Переглядів: 8724