§ 12. Значення періодичного закону
Опанувавши матеріал параграфа, ви зможете:
• пояснювати наукові факти, що розкривають взаємозв’язки між елеметами, їх простими та складними речовинами; значення класифікації в науці;
• оцінювати наукове значення періодичного закону.
Відкриття Д. І. Менделєєвим періодичного закону (1869 р.) стало справжнім науковим вибухом, відіграло величезну роль у становленні хімії як науки. Це найзагальпіший закон природи, па основі якого виявлено та встановлено взаємозв'язки між усіма хімічними елементами.
Насамперед відкриття періодичного закону вказало шлях до природної класифікації елементів й утворених ними простих і складних речовин. Виявивши періодичну подібність елементів та їх сполук за властивостями, Д. І. Менделєєв створив таблицю класифікації, яка дозволила пояснити взаємозв'язок між поняттями «елемент» і «проста речовина». Цей взаємозв'язок став фундаментом для об’єднання всіх елементів у систему. Пропущені в таблиці клітинки створили можливість прогнозу-
вати існування ще невідомих науці хімічнихелементів. Відкриття Галію, Скандію та Германію підтвердили прогнози вченого ще за його ЖИТТЯ.
Вивчаючи розташування елементів у періодичній системі, їх відносні атомні маси, Д. І. Менделєєв установив, що серед них є неточно визначені, та виправив ці дані. Прикладом може бути розташування Берилію, що не відповідало його відносній атомній масі 13,5. Через деякий час ученим вдалося уточнити відносну атомну масу Берилію і цим самим підтвердити правильність розташування цього елемента в періодичній системі. Як бачимо, крім наукового значення щодо першої природної класифікації елементів, періодичний закон виконує ще й прогностичну функцію.
Свій подальший розвиток періодичний закон отримав після відкриття будови атома. Це відкриття розкрило фізичну суть періодичного закону, указавши па те, що атоми складаються з однакових елементарних частинок. Цей факт ще раз підтверджує внутрішній взаємозв’язок між усіма елементами, об’єднуючи їх у єдину систему.
Відкриття періодичного закону дало поштовх до розвитку теорії будови атома, що в свою чергу відкрило можливість створення моделей атомів. T навпаки, знання про будову атома розширило розуміння суті періодичного закону й створило умови для нових відкриттів. Закоиомірікхті, закладені в періодичній системі, послугували розвитку інших природничих наук, зокрема геохімії, космічної хімії. Вивчення ядерних реакцій дозволило добувати штучні елементи, які теж віднайшли своє місце в періодичній системі.
На прикладі періодичного закону, що знайшов своє відображення в періодичній системі хімічних елементів, розкриваються об’єктивні закони розвитку природи, як-от: закон єдності та боротьби протилежностей, заперечення заперечення, переходу кількісних змін у якісні. Наведемо приклади.
Закон єдності та боротьби протилежностей пояснюється па прикладі будови самого атома (існування позитивних частинок у ядрі й негативних у електронній оболонці), існування речовин подвійної хімічної природи (явище амфотерності, яке ви будете вивчати пізніше).
Закон заперечення заперечення, чи подвійного заперечення, відстежується, по-перше, під час переходу від хімічно активного ііеметалічиого елемента (галогену) до інертного (інертні гази), а по-друге, від інертного елемента — до хімічно активного металічного. Іншими словами, подвійне заперечення відбувається на проміжках «галоген інертний елемент лужний метал» у кожному випадку. Чим пояснюється така різка зміна властивостей? Перший раз незавершеністю зовнішнього енергетичного рівня. У галогенів до його завершення бракує одного електрона, тобто найменшої кількості. Різка зміна на проміжку «інертний елемент — лужний металічний», тобто другий раз, появою в металічного елемента нового енергетичного рівня.
Підтвердження закону переходу кількісних змін у якісні легко спостерігати, досліджуючи зміни зарядів атомних ядер. З появою нового протона в ядрі атома, а відповідно й нового електрона на зовнішньому енергетичному рівні, утворюється новий хімічний елемент. У цьому полягає світоглядне значення періодичного закону, підтвердження існування об’єктивних законів природи.
Періодичний закон має велике практичне значення. Періодичною системою, створеною на основі закону, користуються науковці під час наукових відкриттів не тільки в галузі хімії, а й у фізиці, геології, оскільки він акумулює знання всіх природничих наук. У школі ви користуєтеся періодичною системою хімічних елементів як довідником і як наочним посібником не тільки на уроках хімії, а й фізики, щоб пояснити будову атома. Інформація, закладена в періодичній системі, розкриває закономірності, за участю яких можна передбачати й прогнозувати появу нових хімічних елементів і їх сполук.
' ЦІКАВО ЗНАТИ
• Періодичний закон продовжує своє «життя» у працях сучасних дослідників. Здійснено відкриття чотирьох нових хімічних елементів: 113, 115, 117 і 118, які вже внесені в періодичну систему (див. форзац 2). Вони отримали тимчасові назви: 113 — унунтрій Uut ; 115 — унунпентій Uup; 117 — унунсептій Uus і 118 — унуноктій Uuo. Тому 7 період періодичної системи завершений.
Життя й наукова діяльність Д. І. Менделєєва. Дмитро Iadnmnm Менделєєв(1834 1907) — великий російський учений, який з юнацьких років проявляв інтерес до вивчення природничих наук. По закінченню гімназії й природніїчо-математичного факультету Петербурзького педагогічного інституту він працює учителем природознавства в м. Сімферополі, потім у Першій одеській гімназії при тії і іел вепському ліцеї, а в 23-річному віці стає викладачем Петербурзького у иіверситету.

Наукову діяльність Д. І. Менделєєв розпочав рано. Захистивши магістерську дисертацію «Про питомі об'єми», продовжував дослідження стану та властивостей речовин. Під час наукового стажування в Німеччині досліджував властивості газів і довів, що за певної температури вони перетворюються на рідини.
Повернувшись із Німечини, Д. ї. Менделєєв проводить численні експерименти з вивчення властивостей розчинів і в 1865 р. захищає докторську дисертацію «Про з'єднання спирту з водою». Через два роки він уже очолює кафедру неорганічної хімії університету. З-під його пера виходить перший підручник «Основи хімії» для вищих навчальних закладів, що перевидавався S разів у Росії та 5 разів англійською, німецькою та французькою мовами — за кордоном.
У 1869 р., маючи тільки 35 років, учений публікує таблицю елементів під назвою «Досвід системи елементів, заснованої на їхній атомній вазі і хімічній схожості». Таблиця графічний вираз відкритого ним періодичного закону.
У 1890 р. змушений покинути роботу в Петербурзькому університеті через конфлікт з міністром освіти. Через три роки (1893 р.) Д. І. Менделєєв очолює Головну палату мір і ваги.
Наукова діяльність Д. І. Менделєєва не обмежувалася тільки хімією. Він працював у різних галузях науки і скрізь одержував високі результати. Відомі праці вченого з економіки та розвитку промисловості. Багато уваги приділив розвитку нафтової промисловості, вивчав американський досвід її функціонування. З цією ж метою дослідник відвідував кавказькі родовища нафти. Д. Т. Менделєєв проводив низку цікавих досліджень із вивчення складу й способів переробки нафти, використання продуктів її
переробки для промислового виробництва товарів. Після відвідання Донбасу вивчає економічний стан регіону, пропонує нивку заходів для раціонального використання ресурсів краю, запропонував також ідею підземної газифікації вугілля.
Велику увагу Д. ї. Менделєєв приділяв розвитку освіти. Зокрема, він брав участь у створенні Київського політехнічного інституту, тісно співпрацював з науковцями Харківського університету. Постійно працював зі студентами, вимогливо ставився до результатів їхнього навчання.
Учений любив музику, живопис, захоплювався художньою літературою, особливо романами Ж. Берна. Незважаючи на зайнятість, Дмитро Іванович майстрував скриньки, виготовляв валізи й рамки для портретів, оправляв книжки. До свого хобі він ставився дуже серйозно, і речі, зроблені його руками, відрізнялися високою якістю.
Наукові заслуги вченого визнані за його життя. Д. І. Менделєєв був обраний почесним членом майже всіх наукових академій Європи й Америки. Добутий американськими вченими новий 101 хімічний елемент названо на честь великого наукового сподвижн и ка Менделеєтй.
Не буде помилкою визнати, іцо вченому вдалося випередити час на багато років і здобути всесвітню славу та шану багатьох поколінь.
ПІДСУМОВУЄМО ВИВ НЕПЕ
• Періодичний закон — універсальний закон природи, що відкрив шлях до наукового розуміння класифікації елементів та утворених ними сполук. Використовується в багатьох галузях наук і різноманітних технологіях.
• Унікальність періодичного закону полягає в тому, що він має не тільки наукове, а й прогностичне та світоглядне значення. Підтверджує існування й закономірності дії об'єктивних законів природи та їх практичного застосувавання в різних галузях природничих наук.
• Періодична система хімічних елементів, закономірності періодичної зміни властивостей елементів використовуються не тільки в сучасній хімії, а й у фізиці, ядерній хімії та фізиці, геології, геохімії тощо.
• Наукова діяльність Д. І. Менделєєва є справжнім науковим подвигом, визнаним у світі. Вона є прикладом цілеспрямованості в
досягненні наукових цілей, може слугувати зразком високого громадянського обов'язку, служіння науці та своїй країні.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Поясніть значення періодичного закону: а) для розвитку природничих наук; б) розкриття взаємозв’язків між будовою атомів елементів та їх властивостями, а також властивостями утворених ними простих і складних речовин.
2. Розкрийте значення періодичного закону в створенні штучних хімічних елементів.
3. Охарактеризуйте значення періодичного закону: а) прогностичне; б) світоглядне.
4. Оцініть наукове значення періодичного закону.
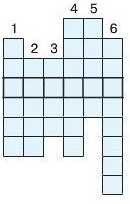
5. Заповніть вертикальні стовпці й у горизонтальному рядку отримаєте назву складової періодичної системи.
1. Елемент, проста речовина якого утворює чорний порошок за нагрівання.
2. Елемент головної підгрури Vl групи.
3. Галоген, що є леткою рідиною бурого кольору.
4. Елемент, оксид якого використовують у ювелірній справі.
5. Газ, яким наповнюють трубки для виготовлення реклами.
6. Перший елемент періодичної системи.
* ЦІКАВО ЗНАТИ
• Наукові праці Д. І. Менделєєва відносяться переважно до загальної хімії. Однак вони стосуються й фізики, ядерної фізики, хімічної технології, економіки, сільського господарства, метрології, географії, метеорології.
Ідея підземної газифікації вугілля, запропонована Д. І. Менделєєвим у 1880 р., знайшла своє практичне втілення у 1937 р. на Донбасі.
НАВЧАЛЬНИЙ ПРОЕКТ
І. Оберіть самостійно або з допомогою вчителя тему навчального проекту з тих, що подані нижче.
1. З історії відкриття періодичної системи хімічних елементів.
2. Форми періодичної системи хімічних елементів.
II. Проведіть презентацію проекту.
УЗАГАЛЬНЕННЯ ЗНАНЬ ІЗ ТЕМИ 1
«ПЕРІОДИЧНИЙ ЗА KOII І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ. БУДОВА АТОМА»

Графічна електронна формула позначається квадратом — це орбіталь. Кількість електронів на орбіталі зображають стрілкою. Якщо зображена одна стрілка, електрон неспаре-ний. Якщо орбіталь заповнена, її позначають двома стрілками, електрони спарені.

Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:54, Переглядів: 4838