§ 28. Классы неорганических соединений
Вспомните:
• какие соединения относятся к оксидам и гидратам оксидов (§ 1);
• как определить принадлежность оксидов к кислотным или осн0вным; чем отличаются кислоты и основания;
• как определять степень окисления по формуле соединений и как определить характерные для элементов степени окисления (§ 21, 22);
• степень окисления Оксигена в большинстве случаев -2, Гидрогена — +1;
• как составлять формулы соединений по степени окисления элементов (§ 22);
• гидраты — это продукты присоединения воды к веществам, в частности к оксидам.
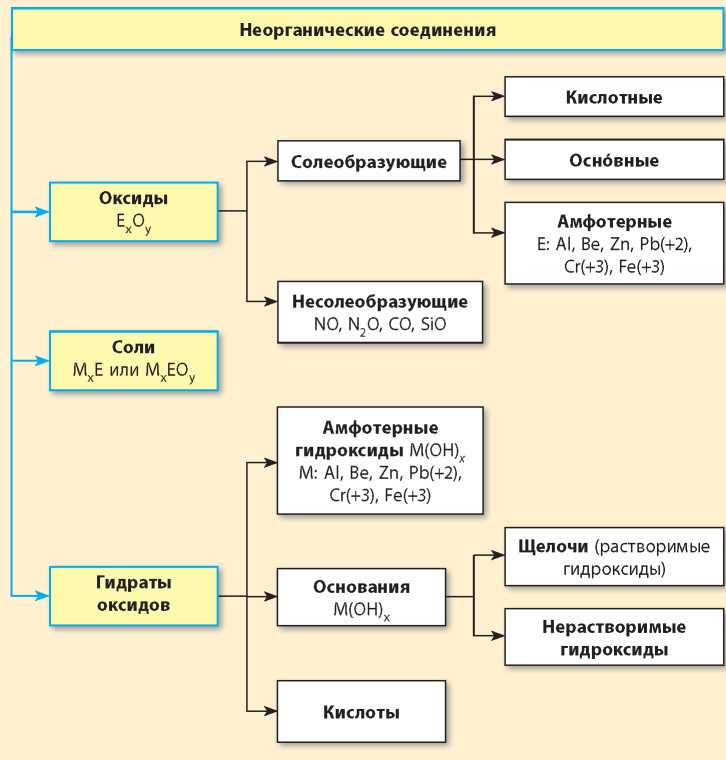
Классификация неорганических соединений
В природе насчитывается свыше пяти миллионов неорганических соединений. Чтобы проще было их изучать и исследовать, вещества разделяют на классы по различным признакам.
Класс соединений — это группа веществ, объединенных по определенному общему признаку.
В 7 классе вы уже ознакомились с оксидами и их гидратами (кислотами и основаниями) (схема 1, с. 6). В 8 классе вы расширите
свои знания об этих классах, а также ознакомитесь с более детальной классификацией неорганических соединений (схема 3).
Схема 3. Важнейшие классы неорганических соединений
Оксиды
Вы уже знаете, что оксиды состоят из атомов двух химических элементов, один из которых — Оксиген.
Среди оксидов выделяют солеобразующие и несолеобразующие оксиды.
Солеобразующие оксиды — это оксиды, которым соответствуют основные или кислотные соединения. Солеобразующие оксиды разделяют на такие группы:
кислотные оксиды — это оксиды, гидраты которых являются кислотами. К этой группе относится большинство оксидов неметаллических элементов и оксиды металлических элементов со степенью окисления больше +3, например: SO3, CO2, NO2, CrO3, Mn2O7 и др. Кислотные оксиды также называют ангидридами кислот, т. е. «безводными кислотами»;
основные оксиды — это оксиды, гидраты которых являются основаниями. К этой группе относятся оксиды металлических элементов со степенью окисления не больше +3, например: CaO, Na2O, MgO, BaO, FeO и др;
амфотерные оксиды — это оксиды, обладающие свойствами как кислотных, так и основных оксидов. К ним относятся: BeO, ZnO, Al2O3, PbO, Cr2O3, Fe2O3 и др.
Несолеобразующие оксиды — это оксиды, которым не соответствует ни кислота, ни основание. К ним относятся: NO, N2O, CO, SiO.
Формулы оксидов — ExOy — составляют по степени окисления элементов (см. алгоритм на с. 111).
Названия оксидов составляют следующим образом:
• для элементов с постоянной валентностью:

например: Na2O — натрий оксид, CaO — кальций оксид; • для элементов с переменной валентностью:
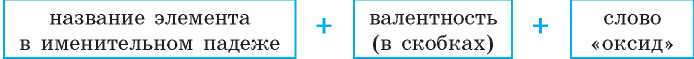
например: CO — карбон(П) оксид, SO2 — сульфур(^) оксид.
Названия оксидов неметаллических элементов иногда составляют без указания валентности, а только указывая число атомов Оксигена в молекуле греческими числительными (моно, ди, три и т. п.). Например, NO — нитроген монооксид, CO2 — карбон диоксид. Иногда соотношение атомов не является целым числом, в этом случае используют префикс геми-, который означает «половина». Так, N2O — нитроген гемиоксид (подразумевается, что на один атом Нитрогена приходится половина атома Оксигена), N2O5 — нитроген гемипентаоксид (на один атом Нитрогена приходится половина от пяти, т. е. два с половиной атома Оксигена).
Кислоты
> Кислоты — это соединения, состоящие из ионов Гидрогена, которьк можно заменить ионами металлических элементов, и кислотного остатка
В формулах кислот на первом месте пишут символ Гидрогена а другие символы обозначают состав кислотного остатка:

Названия и формулы важнейших кислот, которые следует запомнить, приведены в таблице 8.
Кроме состава кислотного остатка, важно знать его заряд (это понадобится для составления формул солей). У ионов Гидрогена заряд +1, поэтому, по принципу электронейтральности, заряд кислот-
ного остатка равен числу ионов Гидрогена, но со знаком
Обратите внимание, что заряд кислотного остатка также равен сумме степеней окисления элементов, из которых он состоит. Так,
+ 1 +6 -2
в сульфатной кислоте степени окисления H2 S O4. Если в кислотном остатке сложить заряды на всех атомах Сульфура и Оксигена, то также получим -2.
Таблица 8. Важнейшие кислоты
|
Название |
Формула |
Традиционное название |
Кислотный остаток |
Название кислотного остатка |
|
Бромидная |
 |
Бромоводородная |
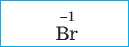 |
Бромид |
|
Йодидная |
 |
Йодоводородная |
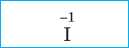 |
Йодид |
|
Карбонатная |
 |
Угольная |
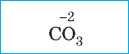 |
Карбонат |
|
Нитратная |
 |
Азотная |
 |
Нитрат |
|
Нитритная |
 |
Азотистая |
 |
Нитрит |
|
Силикатная |
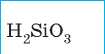 |
Кремниевая |
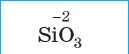 |
Силикат |
|
Название |
Формула |
Традиционное название |
Кислотный остаток |
Название кислотного остатка |
|
Сульфатная |
 |
Серная |
 |
Сульфат |
|
Сульфитная |
 |
Сернистая |
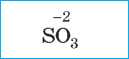 |
Сульфит |
|
Сульфидная |
 |
Сероводородная |
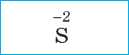 |
Сульфид |
|
Ортофосфатная |
 |
Фосфорная, ортофосфорная |
 |
Ортофосфат |
|
Метафосфат ная |
 |
Метафосфорная |
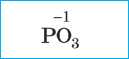 |
Метафосфат |
|
Флуоридная |
 |
Фтороводородная, плавиковая |
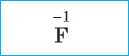 |
Флуорид |
|
Хлоридная |
 |
Хлороводородная, соляная |
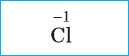 |
Хлорид |
|
Этановая |
 |
Уксусная |
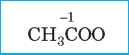 |
Ацетат |
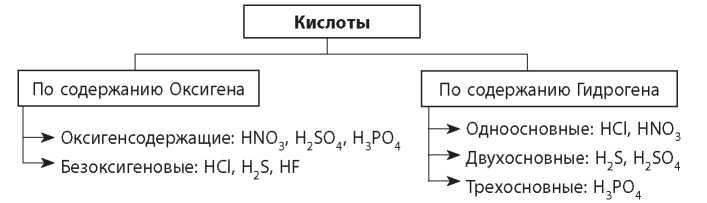
Кислоты классифицируют по двум признакам: по содержанию Оксигена и по основности.
Основность кислоты — это число ионов Гидрогена, способных замещаться ионами металлических элементов.
Основность кислоты не всегда совпадает с числом атомов Гидрогена в ее молекуле. Такие исключения часто встречаются среди органических кислот, таких как уксусная, лимонная, виноградная и др. Так, уксусная кислота ^3TOOH одноосновная. Ее молекулы содержат по четыре атома Гидрогена, но только один атом способен замещаться атомом металлического элемента. Среди неорганических кислот также встречаются такие исключения: фосфитная кислота H^O3 — двухосновная, а гипофосфатная кислота H3PO2 — одноосновная. Среди неорганических кислот, приведенных в таблице 8, таких исключений нет.
Основания (гидроксиды)
Основания — это соединения, состоящие из ионов металлического элемента и одного или нескольких гидроксид-ионов OH-.
В формулах оснований на первом месте пишут символ металлического элемента, а затем — группу OH:
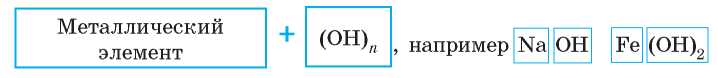
Как определить число групп OH (n) в формулах оснований? В большинстве соединений Оксиген имеет степень окисления -2, а Гидроген — +1, поэтому группа OH (гидроксид-ион) имеет заряд -1: OH-1. Зная это, легко составлять формулы гидроксидов: число гидроксид-ионов в составе формульной единицы будет равно заряду
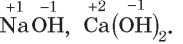
металлического элемента, например:
Названия оснований составляют следующим образом: • для элементов с постоянной валентностью:

например: Ca(OH)2 — кальций гидроксид, NaOH — натрий гидроксид;
• для элементов с переменной валентностью:
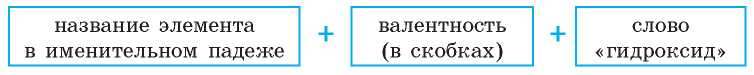
например: Fe(OH)2 — феррум(ІІ) гидроксид, Cu(OH)2 — купрум(П) гидроксид.
Неорганические основания еще называют гидроксидами.
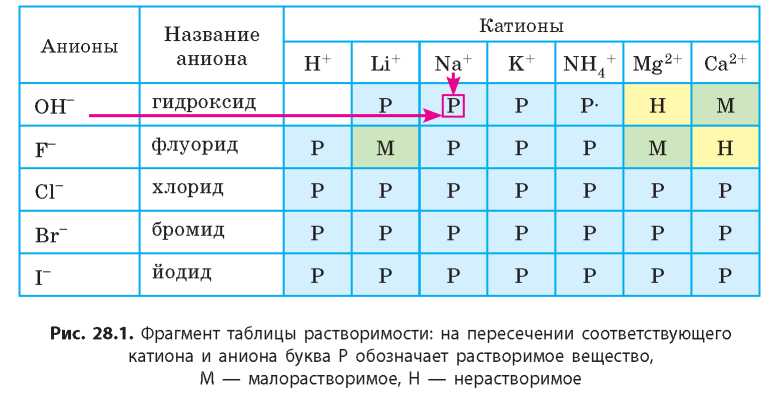
Среди неорганических оснований выделяют две группы: щелочи (растворимые гидроксиды) и нерастворимые гидроксиды. Растворимость гидроксидов (как и других веществ) можно определить по таблице растворимости (см. форзац 2). Например, основание NaOH, которое состоит из катионов Na+ и анионов OH-, является растворимым (рис. 28.1).
Амфотерные гидроксиды
Амфотерные гидроксиды — это гидроксиды, которые проявляют свойства и кислот, и оснований.
Амфотерные гидроксиды являются гидратами амфотерных оксидов, так как они образованы теми же элементами, что и амфотерные оксиды. К амфотерным гидроксидам относятся: Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Fe(OH)3, Pb(OH)2.
Соли
В быту солью мы обычно называем лишь одну соль — поваренную, т. е. натрий хлорид NaCl. Однако в химии солями называют целый класс соединений.
Соли — это соединения, состоящие из ионов металлических элементов и кислотных остатков.
В формулах солей на первом месте пишут символ металлического элемента, а затем — кислотный остаток:

Названия солей составляют следующим образом: • для элементов с постоянной валентностью:

например: K2SO3 — калий сульфит, CaCO3 — кальций карбонат; • для элементов с переменной валентностью:

например: FeSO4 — ферум(ІІ) сульфат, CuCl2 — купрум(П) хлорид.
Формулы солей составляют аналогично формулам оксидов, уравнивая заряды атомов металлического элемента и кислотного остатка.
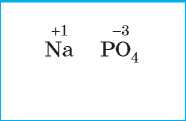
Алгоритм составления формул солей (на примере натрий ортофосфата и алюминий силиката)
|
1. Записываем символ металлического элемента (на первом месте) и кислотного остатка, указываем их заряды |
 |
 |
|
2. Вычисляем наименьшее общее кратное (НОК) для значений зарядов |
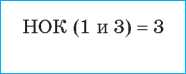 |
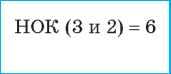 |
|
3. Вычисляем индексы, разделив НОК на заряд металлического элемента и кислотного остатка |
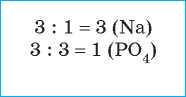 |
 |
|
4. Записываем индексы после символов металлического элемента и кислотного остатка |
 |
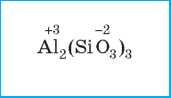 |
У некоторых солей, широко используемых в быту, кроме научных, есть бытовые (традиционные) названия. Например, вы уже знаете, что натрий хлорид NaCl называют поваренной, или каменной, солью, натрий карбонат Na2CO3 — это кальцинированная сода, калий карбонат K2CO3 — поташ. Традиционные названия наиболее употребляемых солей приведены в Приложении 1.
• Чистая поваренная (каменная) соль — бесцветное вещество. А вот «деликатесная», или «царская», соль нежно-розового цвета, имеет приятный запах благодаря содержанию микроскопических водорослей. В Украине такая соль встречается по берегам соленых Сивашских озер, расположенных на западе Азовского моря. Именно отсюда начинался путь украинских чумаков.
• Редко, но встречается и синяя каменная соль. В ней содержатся избыточные ионы Натрия, т. е. в кристалле соли ионов Натрия немного больше, чем ионов Хлора. Это и обусловливает синий цвет. При растворении такой соли в воде образуется обычный бесцветный раствор.
Лингвистическая задача
Формула кислоты полностью отображена в ее названии. Основу названия составляет название образующего ее химического элемента (элемент Сульфур образует сульфатную, сульфитную и сульфидную кислоты). Суффиксами обозначается степень окисления этого элемента. Если элемент, образующий кислоту, находится в высшей степени окисления, то в названии кислоты пишут суффикс -ат-: сульфатная H2SO4 (степень окисления Сульфура +6 — высшая). Если степень окисления элемента меньше на 2, то суффикс -ат- заменяют на -ит-: сульфитная H2SO3 (степень окисления Сульфура +4). Если элемент находится в низшей степени окисления, что соответствует безоксигеновым кислотам, то в названии пишут суффикс -ид-: сульфидная H2S (степень окисления Сульфура -2 — низшая). Установите соответствие между названиями кислот, приведенными в таблице 8, и степенями окисления химических элементов, которые их образуют.
Выводы
1. Оксиды состоят из атомов двух химических элементов, один из которых — Оксиген. Названия оксидов состоят из двух слов: первое — название химического элемента, образующего оксид, второе — слово «оксид». Для элементов с переменной валентностью в названии оксидов обязательно указывают валентность элемента.
2. Кислоты состоят из ионов Гидрогена и кислотных остатков. По содержанию Оксигена кислоты разделяют на оксигенсодержащие и безок-сигеновые. По числу атомов Гидрогена — на одноосновные, двухосновные и трехосновные.
3. Неорганические основания называют гидроксидами. Они состоят из ионов металлических элементов и гидроксид-ионов OH-. Число гидроксид-ионов в составе гидроксидов равно степени окисления металлического элемента. Среди гидроксидов выделяют щелочи (растворимые в воде гидроксиды) и нерастворимые гидроксиды. Названия гидроксидов состоят из двух слов: названия металлического элемента и слова «гидроксид».
4. Амфотерные гидроксиды — это гидроксиды, проявляющие свойства и кислот, и оснований.
5. Соли состоят из ионов металлических элементов и кислотных остатков. Названия солей состоят из двух слов: названия металлического элемента и названия кислотного остатка. Для элементов с переменной валентностью указывают их валентность в соединении.
Контрольные вопросы
1. Какие вещества называют оксидами? Приведите примеры оксидов.
2. Запишите общую формулу оксидов.
3. Как по химической формуле определить, кислотный оксид или основный?
4. Какие оксиды относятся к несолеобразующим?
5. Дайте определение кислотам. Что называют кислотным остатком?
6. По каким признакам классифицируют кислоты? Назовите группы, на которые распределяют кислоты по разным признакам, и приведите соответствующие примеры.
7. Какие вещества относятся к классу оснований? Какие из них являются щелочами?
8. Какие соединения относятся к солям?
9. Вещества, формулы которых KNO3, FeCl2, Na2SO4, называют: а) солями; б) кислотами; в) основаниями; г) оксидами.
10. Вещества, формулы которых HNO3, HCl, H2SO4, называют: а) солями; б) кислотами; в) основаниями; г) оксидами.
11. Вещества, формулы которых NO2, Fe2O3, Na2O, называют: а) солями;
б) кислотами; в) основаниями; г) оксидами.
12. Соли образованы: а) ионами металлических элементов и кислотными остатками; б) ионами металлических элементов и гидроксид-ионами;
в) ионами Гидрогена и кислотными остатками.
13. В формулах кислот на первом месте записан символ: а) Оксигена; б) Гидрогена; в) Сульфура; г) Карбона.
Задания для усвоения материала
1. Определите степени окисления элементов в оксидах и запишите их названия: P2O5, SO2, Na2O, MgO, CaO, Mn2O7, SnO2, I2O5, CrO3, Cu2O, CuO.
2. Приведите примеры несолеобразующих оксидов. Почему их так называют?
3. Составьте формулы следующих оксидов: калий оксид, фосфор(ІІІ) оксид, аргентум(І) оксид, феррум(ІІ) оксид, хлор(ІУ) оксид, нитроген(У) оксид, цинк оксид, аурум(ІІІ) оксид, сульфур(УІ) оксид, ванадий(У) оксид.
4. Запишите формулы хлоридной, сульфатной, ортофосфатной, карбонатной, силикатной, сульфидной и нитратной кислот. Подчеркните кислотные остатки и определите их заряд.
5. Приведите примеры оксигенсодержащих и безоксигеновых кислот.
6. Составьте формулы гидроксидов Калия, Магния, Станнума(ІІ), Цинка, Хрома(ІІІ), Купрума(ІІ), Бария. Подчеркните формулы щелочей.
7. Из таблицы 8 выпишите формулы кислот: а) оксигенсодержащей одноосновной; б) безоксигеновой двухосновной; в) оксигенсодержащей трехосновной; г) безоксигеновой одноосновной; д) оксигенсодержа-щей двухосновной.
8. Из таблицы растворимости (см. форзац 2) выпишите по два примера формул солей: а) хлоридной кислоты, нерастворимых в воде; б) карбонатной кислоты, растворимых в воде.
9. Назовите соли: K2SO4, Q(NO3)3, MgCl2, CuSO4, SnCl2, AgNO3, AlPO4, BaSO3, BaS, BaSO4, Na2SiO3, NaBr, MnSO4, Ag2S, Mg3(PO4)2. Укажите над формулами значения заряда металлического элемента и кислотного остатка.
10. Составьте формулы солей: кальций хлорид, магний карбонат, цинк нитрат, калий карбонат, натрий сульфат, кальций силикат.
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:40, Переглядів: 2891