§ 11. Плавлення та кристалізація
Чи замислювалися ви над тим, чому грудочка снігу в руці тане? Чому утворюються крижані бурульки і коли вони утворюються — у відлигу чи, навпаки, в мороз? як охолодити трохи снігу без морозильної камери? Чому шматочок свинцю можна розплавити в сталевій ложці, а шматочок сталі у свинцевій — не можна? Вивчивши матеріал цього параграфа, ви зможете відповісти на ці запитання.
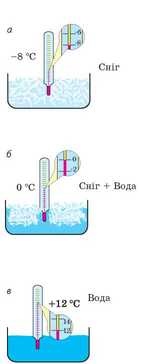
рис. 11.1. Спостереження процесу танення снігу в кімнаті: а — за від'ємної температури вода перебуває у твердому стані; б — за температури 0 °С сніг починає танути, в процесі танення температура суміші незмінно дорівнює 0 °С; в — за додатної температури вода перебуває в рідкому стані
Знайомимося з процесами плавлення та кристалізації, дізнаємося про температуру плавлення
Якщо трохи снігу занести до теплої кімнати, через деякий час сніг розтане, або, як кажуть фізики, розплавиться.
плавлення — це процес переходу речовини з твердого стану в рідкий.
Простежимо зміну температури снігу в процесі його танення в теплій кімнаті (рис. 11.1). На початку досліду температура снігу є нижчою за 0 °С, сніг не тане, а його температура швидко збільшується (рис. 11.1, а). Щойно стовпчик термометра досягає позначки 0 °С, температура перестає збільшуватись, а в склянці з’являється вода (сніг починає плавитися). Обережно перемішаємо воду із залишками снігу й відзначимо, що температура суміші залишається незмінною (рис. 11.1, б). І тільки після того як сніг повністю розплавиться, температура знову починає зростати (рис. 11.1, в).
Досліди показують: практично всі
кристалічні речовини починають плавитися після досягнення ними певної (власної для кожної речовини) температури; у процесі плавлення температура речовини не змінюється.
Температура плавлення — це температура, за якої тверда кристалічна речовина плавиться, тобто переходить у рідкий стан.
Отже, тверда речовина в разі досягнення певної температури перетворюється на рідину. Так само рідини за певних умов тверднуть (кристалізуються). Наприклад, якщо
винести воду на мороз або поставити посудину з водою в морозильну камеру, то вода з часом закристалізується, перетворившись на лід (рис. 11.2).

Кристалізація — це процес переходу речовини з рідкого стану в кристалічний.
Вимірюючи температуру речовин у процесі їх охолодження й подальшої кристалізації, доходимо таких висновків:
1) у процесі кристалізації температура речовини не змінюється;
2) процес кристалізації починається тільки після охолодження рідини до певної для цієї рідини температури;
3) температура кристалізації дорівнює температурі плавлення.
У різних речовин температура плавлення та кристалізації досить сильно різниться. Так, температура плавлення спирту становить -115 °С,
ртуті--39 °С, льоду — 0 °С; сталь плавиться за температури 1400 °С,
свинець — 327 °С, а щоб розплавити вольфрам, його слід нагріти до величезної температури 3387 °С.
Сподіваємось, тепер ви легко можете відповісти на запитання: чому шматок свинцю можна розплавити в сталевій ложці, а шматок сталі у свинцевій ложці — не можна?
Температура плавлення (кристалізації) — це характеристика речовини, тому її визначають експериментально й заносять у таблиці (див. табл. 2 Додатку). У цій таблиці немає аморфних речовин, адже вони, як ви вже знаєте, не мають певної температури плавлення: нагріваючись, аморфні речовини поступово м’якшають, а в ході охолодження поступово густішають. Надалі, вивчаючи процеси плавлення та кристалізації, ми розглядатимемо тільки кристалічні речовини.
Будуємо графік і пояснюємо процеси плавлення та кристалізації
Для детальнішого вивчення процесів плавлення та кристалізації речовин розглянемо графік залежності температури кристалічної речовини (льоду) від часу її нагрівання та охолодження (рис. 11.3).
На момент початку спостереження (точка A) температура льоду становила -20 °С. Під час подальшої роботи нагрівника температура льоду збільшується (ділянка AB). З погляду молекулярно-кінетичної теорії будови речовини в цей час збільшується кінетична енергія коливального руху молекул води у вузлах кристалічної ґратки льоду.
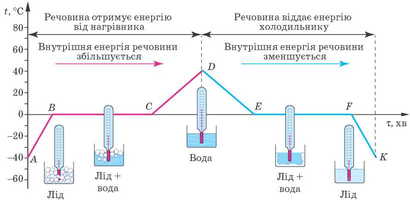
Рис. 11.3. Графік плавлення та кристалізації льоду. Графік матиме таку симетричність, якщо кількість теплоти, яку щохвилини отримує лід, а потім вода під час роботи нагрівника, дорівнюватиме кількості теплоти, яку щохвилини віддає та сама речовина під час роботи холодильника
Після досягнення температури 0 °С лід починає плавитися, його температура не змінюється (ділянка ВС) незважаючи на те, що нагрівник продовжував працювати й передавати льоду певну кількість теплоти. Уся енергія, що надходить від нагрівника, йде на руйнування кристалічної ґратки льоду. У цей інтервал часу внутрішня енергія льоду зростає тільки за рахунок збільшення потенціальної енергії взаємодії молекул.
Після того як весь лід розплавився й перетворився на воду (точка С), її температура починає збільшуватися (ділянка CD), тобто починає зростати кінетична енергія руху молекул.
У той момент, коли температура сягнула 30 °С (точка D), нагрівник вимкнули. Воду помістили в холодильник, і її температура почала падати (ділянка DE). Зниження температури свідчить про те, що кінетична енергія, а отже, швидкість руху молекул зменшуються.
Коли досягнуто температури кристалізації 0 °С (точка E), швидкість руху молекул зменшується настільки, що вони вже не можуть перестрибувати з місця на місце. Вони поступово займають фіксовані положення (ділянка EF), і до моменту завершення кристалізації вже всі молекули коливаються біля положень рівноваги. Вода переходить у стан із меншою внутрішньою енергією — повністю перетворюється на лід (точка F).
Під час подальшої роботи холодильника замерзла вода (лід) холоне, а кінетична енергія коливального руху молекул зменшується (ділянка FK).
Переконуємося, що процеси плавлення та кристалізації неможливі без теплообміну
Якщо помістити сніг у холодильну камеру, температура в якій є незмінною й дорівнює 0 °С, з’ясується таке.
Як і в досліді з таненням снігу в теплій кімнаті, температура снігу буде спочатку збільшуватися (правда, повільніше). Адже температура в камері вища за температуру снігу, тому більш тепле повітря в ній віддає певну кількість теплоти більш холодному снігу. Збільшення температури триватиме доти, доки температура снігу не стане 0 °С. І отут починається найцікавіше. Температура снігу сягнула температури плавлення, а сніг не тане (рис. 11.4). Чому?
Згадайте: перший дослід проводився в теплій кімнаті (температура в якій була вищою за 0 °С). Отже, протягом усього часу спостереження відбувався теплообмін між повітрям у кімнаті та снігом. При цьому весь час сніг одержував енергію, зокрема й тоді, коли його температура залишалася незмінною. І сніг при цьому танув. У другому досліді температура плавлення снігу й температура повітря в холодильній камері є однаковими, тому теплообмін не відбувається. Сніг не одержує енергії, отже, й не тане.
Якщо в холодильну камеру, температура в якій 0 °С, помістити теплу воду, то зрозуміло, що вода буде охолоджуватися (тепла вода буде віддавати енергію повітрю в камері). Однак після досягнення температури 0 °С вода не кристалізуватиметься, оскільки тепер, щоб перейти в стан із меншою внутрішньою енергією, їй потрібно віддати довкіллю певну кількість теплоти, а у випадку теплової рівноваги теплообмін не відбувається.
Підбиваємо підсумки
Тепловий процес переходу речовини з твердого стану в рідкий називають плавленням. У процесі плавлення температура кристалічної речовини не змінюється.
За однакової температури внутрішня енергія речовини в рідкому стані більша за внутрішню енергію речовини в твердому стані.
Щоб речовину перевести з твердого стану в рідкий, необхідне виконання двох обов’язкових умов: по-перше, потрібно нагріти речовину до температури плавлення; по-друге, під час плавлення речовина має одержувати енергію.
Процес переходу речовини з рідкого стану в твердий називають кристалізацією. Температура кристалізації дорівнює температурі плавлення.
Щоб речовину перевести з рідкого стану в кристалічний, так само мають бути виконані дві умови: по-перше, рідину потрібно охолодити до температури кристалізації; по-друге, під час кристалізації речовина повинна мати можливість віддавати енергію.
Контрольні запитання
1. Який процес називають плавленням? 2. Як змінюється температура речовини в процесі плавлення? 3. Який процес називають кристалізацією? 4. Порівняйте температури плавлення і кристалізації речовин.
5. Чи танутиме лід у холодильнику, температура в якому становить 0 °С? А чи замерзатиме за такої температури вода? 6. Опишіть процеси, що відбуваються під час плавлення льоду та кристалізації води.
Вправа №!11
1. Чому волосок розжарювання електричної лампи виготовляють із вольфраму?
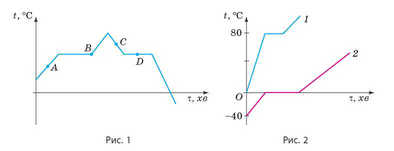
2. На рис. 1 наведено графік плавлення та кристалізації певної речовини. Якому стану речовини від повідають точки A, B, C і D графіка?
3. На рис. 2 подано графіки плавлення деяких речовин. У якої з речовин вища температура плавлення? Яка з речовин на початку досліду мала вищу температуру? Скориставшись табл. 2 Додатку, визначте, про які речовини йдеться.
4. У відрі з водою плавають шматки льоду. Чи танутиме лід, чи вода замерзатиме? Від чого це залежить?
5. Скористайтесь додатковими джерелами інформації та дізнайтеся, коли і чому утворюються бурульки.
6. Які з наведених фізичних речовин є характеристикою тіла?
а) маса; б) жорсткість; в) об’єм; г) густина; д) кінетична енергія; е) питома теплоємність.
Експериментальне завдання
«Морозна сіль». Змішайте 100 г снігу, узятого за температури 0 °С, і 30 г кухонної солі (1 столова ложка з гіркою). Сніг почне швидко танути й охолоджуватися. Якщо в такий розчин опустити шматочок картоплини, то він замерзне. Поясніть чому. (Підказка: температура кристалізації водного розчину солі менша, ніж температура замерзання води, і залежить від концентрації розчину.)
Це матеріал з Підручника Фізика 8 Клас Бар'яхтар
Автор: evg от 7-08-2016, 20:10, Переглядів: 8891