Повітря, його склад. Оксиген. Кисень, його фізичні властивості
Факти - це повітря науковця.
І.П. Павлов
Опрацювавши матеріал параграфа, ви зможете:
• назвати якісний та кількісний склад повітря, склад молекули кисню;
• описати історію відкриття кисню, його фізичні властивості.
Повітря — природна суміш газів. Це ви знаєте з курсу природознавства. Які гази й у якій кількості входять до складу повітря? Пригадати ці відомості вам допоможуть діаграми на рисунку 17.1.
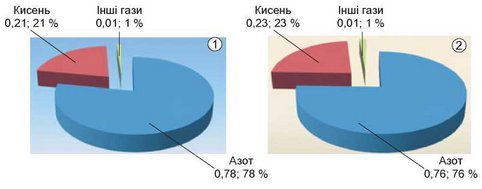
Рис. 17.1. Середній склад сухого повітря: об’ємні (1) і масові (2) частки (у частках від одиниці й відсотках) газів у ньому
Окрім азоту, кисню, вуглекислого газу, у повітрі є водяна пара, озон, домішки пилу, інших газів тощо (докладніше про склад повітря - у таблиці 6 Додатка).
Відкриття кисню дотепер залишається предметом наукової дискусії істориків хімії.
ЦікаВо і пізнаВально
У VIII столітті китайський алхімік Мао Хоа вважав: повітря складається з двох частин, одна з яких підтримує горіння й дихання, а інша - ні.
Є підстави вважати відкривачами кисню щонайменше трьох дослідників: шведського хіміка Карла Вільгельма Шеєле (рис. 17.2.1), англійського священика Джозефа Прістлі (рис. 17.2.2) і французького хіміка Антуана Лорана Лавуазьє (рис. 17.2.3).



Рис. 17.2.1. Шеєле Карл Вільгельм (1742-1786). Шведський хімік і фармацевт. Член Королівської шведської академії наук. Хімію вивчав самотужки. Уперше добув багато неорганічних і органічних речовин, зокрема кисень
Рис. 17.2.2. Прістлі Джозеф (1733-1804). Англійський хімік, філософ, член Лондонського королівського товариства. Відкрив кисень. Проводив експерименти з повітрям, забрудненим різними газами. Виявив, що «повітря, зіпсоване горінням або диханням», стає придатним для дихання внаслідок життєдіяльності зелених частин рослин, одним з продуктів якої є кисень
Рис. 17.2.3. Лавуазьє Антуан Лоран (1743-1794). Французький хімік. Член Паризької академії наук. Його праці сприяли перетворенню хімії на науку, яка ґрунтується на точних вимірюваннях. Експериментально обґрунтував основний закон хімії - закон збереження маси речовин; визначив склад повітря; уперше правильно пояснив явище горіння як процес взаємодії речовин із киснем; довів, що процес дихання подібний до процесу горіння
Перше повідомлення про одержання безбарвного газу, в якому свічка горить яскравіше, ніж у повітрі, а тліюча скіпка спалахує, було зроблено в 1775 році Дж. Прістлі на засіданні Лондонського королівського товариства. Кількома роками раніше кисень добув К. Шеєле і назвав його «вогненним повітрям». Однак він необачливо забарився з оприлюдненням свого відкриття: трактат «Про повітря й вогонь» побачив світ лише 1777 року.
Тим часом у 1775 році А. Лавуазьє повторив досліди Дж. Прістлі та вдосконалив їхню методику. У виступі на засіданні Паризької академії наук учений повідомив, що йому вдалося отримати та описати властивості «найчистішої частини повітря, яке нас оточує». А. Лавуазьє назвав цей складник повітря життєвою основою (спробуйте пояснити чому).
ЦікаВо і пізнаВально
Термін «кисень» уперше запровадив Антуан Лавуазьє 1777 року.

Про кількісний склад повітря. Щоб перевірити правильність міркувань великих хіміків минулого, відтворимо історію досліду. Помістимо в посудину з водою чашку для випарювання, у якій закріпимо свічку (рис. 17.3.1). Запалимо її й хутко накриємо скляним дзвоном, попередньо розміченим на п’ять рівних частин.
З курсу природознавства ви знаєте: поки у дзвоні є кисень - свічка горітиме. Під час горіння кисень витрачатиметься, тож вода заповнюватиме простір, що вивільнився. Тому її рівень у дзвоні п ідвищиться. Свічка погасне, коли кисню у дзвоні не залишиться (рис. 17.3.2).
Результати експерименту засвідчили: рівень води в циліндрі підвищився на одну поділку. Це означає, що об’єм повітря зменшився приблизно на одну п’яту частину. Тобто об’ємна частка кисню в повітрі становить близько 20 % (порівняйте здобуті експериментальні дані з тими, що наведено на діаграмі, зображеній на рисунку 17.1.1). Однак зауважимо, що внаслідок згоряння парафіну свічки утворюється га-зувата речовина - вуглекислий газ С02 й водяна пара ЩО. Це ускладнює точність визначення частки кисню під час згаданого історичного досліду.
Склад молекули кисню вперше правильно визначив італійський науковець Амедео Авогадро (рис. 17.4). Він експериментально встановив відносну молекулярну масу кисню й дійшов висновку, що його молекула складається з двох атомів Оксигену (рис. 11.1).
Пригадайте хімічний знак Оксигену. Зазначте валентність (за потреби скористайтеся таблицею 15.1) і запишіть значення відносної атомної маси цього хімічного елемента.
Запишіть і вимовте хімічну формулу кисню. Обчисліть його відносну молекулярну масу. Простою чи складною речовиною є кисень?

Рис. 17.4. Авогадро Амедео (1776-1856). Італійський фізик і хімік (юрист за освітою). Популярність його імені пов’язана з відкриттями в галузі фізики й хімії. У 1811 році заклав основи молекулярної теорії. Цього ж року відкрив закон, названий його ім’ям. Винайшов метод визначення молекулярних мас, першим правильно обчислив атомні маси низки хімічних елементів
Фізичні властивості кисню. За звичайних умов кисень - безбарвний газ, без смаку й запаху. Його густина трохи більша за густину повітря. Твердий кисень плавиться за температури -218 °С. Рідкий кисень кипить за температури -183 °С. Кисень у рідкому стані - блакитна рухлива рідина. Скраплений кисень зберігають у посудинах Дьюара.
ЦікаВо і пізнаВально
У лабораторіях і в промисловості посудину Дьюара використовують для зберігання зрідженого кисню, азоту, гелію. Побутовий термос - різновид посудини Дьюара.
Кисень малорозчинний у воді: за нормальних умов (0 °С, 1 атм) у воді об’ємом 100 л розчиняється кисень об’ємом 5 л. За 20 °С і тиску 1 атм у воді такого самого об’єму розчиняється кисень об’ємом 3,1 л.
Чи не кожен акваріуміст використовує компресори для аерації води. Поясніть, чому в спеку потреба в аерації зростає.
Які фізичні властивості кисню використовують для його збирання в посудину, ви дізнаєтеся з § 20.
ПРО ГОЛОВНЕ
Хімічний символ Оксигену - О, відносна атомна маса - 16, валентність - ІІ.
Молекула кисню складається з двох атомів Оксигену. Відносна молекулярна маса кисню - 32.
За звичайних умов кисень - безбарвний газ, без смаку й запаху, малорозчинний у воді.
Густина кисню трохи більша за густину повітря.
Кисень кипить за температури -183 °С.
Рідкий кисень - блакитна рухлива рідина.
Температура плавлення кисню -218 °С.
Перевірте себе
1. Який склад повітря?
2. Уміст якого газу в повітрі найбільший?
3. Хто відкрив кисень?
4. Як експериментально можна визначити приблизний уміст кисню в повітрі?
5. Який науковець уперше правильно визначив відносну молекулярну масу кисню і склад його молекули?
6. Яка відносна атомна маса Оксигену? Валентність?
7. Скільки атомів у молекулі кисню? Яка його хімічна формула?
8. Які фізичні властивості кисню?
Застосуйте свої знання й уміння
9. Чому кисень, випущений з балона, накопичується в нижній частині виробничого приміщення, заповнює всі приямки та траншеї і надовго там затримується?
10. Чому жива троянда, яку занурили в посудину з рідким киснем, стала крихкою (рис. 17.5)?

11*. Чому науковці тривалий час вважали повітря чистою речовиною, а не сумішшю?
12. Класифікуйте речовини, що є в повітрі (тут і далі див. таблицю 6 Додатка), на прості й складні.
13. Порівняйте якісний і кількісний склад: а) кисню 02 й озону 03; б) кисню 02, азоту И2 й водню Н2; в) вуглекислого газу С02 й нітроген(^) оксиду и02.
14. Визначте валентності хімічних елементів у складних речовинах, які є в повітрі.
15. Обчисліть відносні молекулярні маси складних речовин, які є в повітрі.
16*. Прокоментуйте висловлювання відомого вченого-хіміка А. Лавуазьє: «...Не робити жодного висновку, який не випливав би безпосередньо з досліду і спостереження, не пропонувати нічого понад те, що підтверджує дослід, і нічого не добавляти там, де факти мовчать».
Творча майстерня
17. Підготуйте презентацію «Історія відкриття кисню».
18. За матеріалами Інтернету підготуйте повідомлення про дивовижні властивості рідкого кисню.
Дізнайтеся більше про кисень (с. 179).
Це матеріал з підручника Хімія 7 клас Лашевська
Автор: admin от 12-02-2017, 11:40, Переглядів: 7974