Хімічні властивості кисню
За хімічними властивостями кисень примітний тим, що сполучається з багатьма речовинами.
Д.І. Менделєєв. «Основи хімії»
Опрацювавши матеріал параграфа, ви зможете:
• називати склад оксидів;
• наводити приклади оксидів, реакцій сполучення;
• розрізняти реакції сполучення, пояснювати їхню суть;
• характеризувати хімічні властивості кисню;
• складати рівняння реакцій кисню з воднем, вуглецем, сіркою, магнієм, залізом, міддю, метаном, гідроген сульфідом, глюкозою.
Хімічні властивості кисню. Спалахування тліючої скіпки внаслідок її внесення в посудину з киснем характеризує його хімічні властивості. Адже і деревина, і кисень зазнають хімічних змін.
Використовуючи рисунок 21.1 та власний повсякденний досвід, назвіть умови й зовнішні ефекти перебігу реакції між деревиною й киснем.


Для того щоб дерев’яна скіпка зайнялася, її довелося нагріти в полум’ї пальника до певної температури. Чимало речовин також реагують з киснем лише за попереднього нагрівання.
Щоб пересвідчитися в цьому, виконаємо досліди. Розпечений деревний вуглик, унесений до посудини з киснем, розжарюється аж до білого й швидко згоряє без полум’я та диму (рис. 21.2):
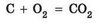
Реакція горіння вугілля відбувається і на повітрі. Вугілля - широко застосоване тверде паливо.
Під тягою нагріємо трохи сірки у сталевій ложці для спалювання речовин (рис. 21.3). Спочатку сірка плавиться. Розплавлена сірка горить на повітрі слабким синім полум’ям. Біля отвору посудини з киснем горіння сірки посилюється. У кисні сірка згоряє яскравим блакитним полум’ям.
Горіння сірки супроводжується виділенням великої кількості світлової й теплової енергії та появою різкого запаху:
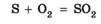
Цей запах свідчить про утворення сірчистого газу Б02, який сильно подразнює слизові оболонки.

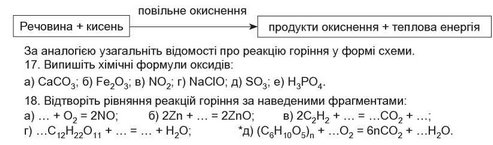
Поясніть, чому сірку потрібно спалювати у витяжній шафі.
Сірчистий газ Э02 згубно діє на мікроорганізми й плісняву. Багато хто для ліпшого збереження овочів перед закладанням їх на зиму спалює у льосі трохи сірки. Яких правил безпеки потрібно дотримуватися під час цього?

Для реакції заліза з киснем також потрібне попереднє нагрівання. Насиплемо у товстостінну посудину піску. Розігріємо у полум’ї пальника пучок дуже тонкого залізного дроту - «сталеву вату». Розжарений дріт унесемо до посудини з киснем. Залізо згоряє сліпучим полум’ям, розкидаючи іскри - розпечені частинки залізної ожарини Ред04 (рис. 21.4, с. 117).
За наведеним фрагментом відтворіть рівняння реакції горіння заліза:
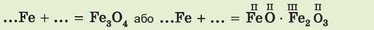

Ця сама реакція відбувається і на повітрі, коли сталь під час механічного обробляння сильно нагрівається від тертя (рис. 21.5).
Умови перебігу й зовнішні ефекти реакцій магнію, міді, водню з киснем вам відомі з попередніх параграфів. Фрагменти рівнянь цих реакцій такі:
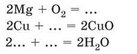
За наведеними фрагментами відтворіть рівняння реакцій горіння.
Проаналізуємо рівняння реакцій сірки, вуглецю, заліза, водню, магнію, міді з киснем. У кожну з реакцій вступає по дві речовини, унаслідок їхньої взаємодії утворюється одна речовина.
Реакції за участю кількох реагентів з утворенням одного продукту називають реакціями сполучення.
Поясніть, які реакції протилежні реакціям сполучення.
Усі продукти розглянутих реакцій сполучення - бінарні сполуки, до складу яких входить Оксиген. Такі сполуки називають оксидами.
Оксиди — складні речовини, утворені двома елементами, одним з яких є Оксиген1.
Реакції речовин з киснем називають реакціями окиснення.
Якщо окиснення супроводжується виділенням світла й тепла, то його зазвичай називають горінням. Часто внаслідок окиснення виділяється лише теплова енергія, реакція триває досить довго. Такий процес нази-
1 В оксидах немає атомів Оксигену, сполучених між собою. Натомість такі атоми Оксигену є в пероксидах, наприклад у гідроген пероксиді Н2О2:
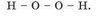
вають повільним окисненням. Він супроводжується повільним виділенням теплової енергії. Приклади взаємодії речовин з киснем без виділення світла: гниття органічних решток, згіркнення масла, ржавіння заліза, дихання тощо.
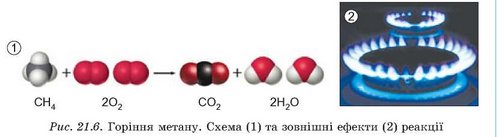
Горіння складних речовин у кисні супроводжується виділенням світлової й теплової енергії. Унаслідок горіння в надлишку кисню утворюються оксиди тих хімічних елементів, які входять до складу речовини. Унаслідок горіння метану в надлишку кисню утворюється вуглекислий газ - карбон(ІУ) оксид і вода (рис. 21.6):
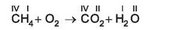
Продуктами згоряння сірководню (гідроген сульфіду) Н2В є сульфур(ІУ) оксид і вода.
Перетворіть схему реакції горіння метану на хімічне рівняння. Складіть рівняння реакції горіння сірководню.
ЦікаВо і пізнаВально
У вересні 1927 р. жителі Криму спостерігали, як Чорне море горить у прямому розумінні цього слова. «Неначе палала пожежа, яскраве світло якої проходило крізь димову завісу», - писав гідролог П.А. Двойченко. Стовпи полум’я сягали висоти 500-800 метрів. Одночасно на узбережжі відчувався запах тухлих яєць. Саме так тхне сірководень, якого вдосталь у Чорному морі. У ті дні поблизу Ялти стався землетрус. Його осередок був під морським дном, а в небі бушувала гроза. Як уважають фахівці, унаслідок сейсмічних поштовхів сірководень вирвався зі дна і загорівся від розряду блискавки.
Продуктами згоряння в кисні глюкози, формула якої С6Н1206, також є вуглекислий газ (карбон(ІУ) оксид) і вода (рис. 21.7). Ці самі речовини утворюються внаслідок повільного окиснення глюкози в організмі людини і тварин. І горіння глюкози, і повільне окиснення супроводжуються виділенням теплової енергії.

Рис. 21.7.Горіння глюкози в кисні
Складіть рівняння реакції горіння глюкози.
Поясніть, чому виснаженим хворим рекомендовано вживати продукти, багаті на глюкозу.
Докладніше про умови виникнення і припинення горіння речовин -у наступному параграфі.
ПРО ГОЛОВНЕ
Чимало речовин реагують з киснем лише за попереднього нагрівання. Реакції за участю кількох реагентів з утворенням одного продукту називають реакціями сполучення.
Оксиди - бінарні сполуки хімічних елементів з Оксигеном.
Кисень реагує з багатьма простими й складними речовинами:
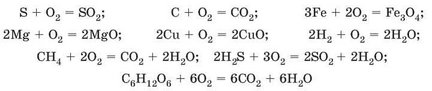
Реакції речовин з киснем називають реакціями окиснення.
Окиснення, що супроводжується виділенням світла й тепла, називають горінням.
Повільне окиснення - процес повільної взаємодії речовин з киснем, що супроводжується повільним виділенням теплової енергії.
Перевірте себе
1. Яка умова часто потрібна для того, щоб речовина прореагувала з киснем?
2. Які зовнішні ефекти супроводжують горіння у кисні сірки, вуглецю, заліза, магнію, водню, метану?
3. Які реакції називають реакціями сполучення?
4. Що таке оксиди?
5. Які реакції називають реакціями окиснення? Горіння?
Застосуйте свої знання й уміння
6. Чому біля отвору посудини з киснем горіння сірки посилюється?
7. Чому під час шліфувальних та заточувальних робіт потрібно надягати захисний спецодяг і маску?
8. Чому реакція розкладу є протилежністю реакції сполучення?
9. Чому продукти горіння метану й глюкози однакові?
10. Чому речовини в кисні згоряють швидше, ніж у повітрі?
11. Чому під час компостування органічних відходів виділяється теплова енергія?
12. Порівняйте зовнішні ефекти реакцій горіння в кисні водню, сірки, вуглецю, заліза, метану, глюкози.
13. Проаналізуйте схеми реакцій, про які йшлося в параграфі. Які із цих реакцій є реакціями сполучення?
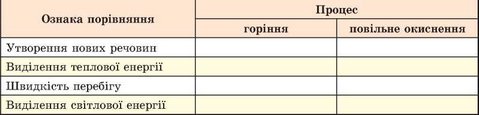
14. Чим подібні й чим відрізняються реакції горіння й повного окиснення? Відповідь оформіть як діаграму Венна.
15. Порівняйте реакції горіння й повільного окиснення. Результати запишіть до таблиці за зразком:
16. Проаналізуйте узагальнювальну схему «Повільне окиснення»:
Творча майстерня
19. Підготуйте презентацію «Горіння й повільне окиснення у довкіллі».
Дізнайтеся більше про хімічні властивості кисню (с. 180).
Це матеріал з підручника Хімія 7 клас Лашевська
Автор: admin от 12-02-2017, 11:43, Переглядів: 6576