Закон збереження маси речовин під час хімічних реакцій
Усі зміни, які в натурі трапляються, такого суть стану, що скільки чого в одного тіла відніметься, стільки само добавиться до іншого.
М.В. Ломоносов
Опрацювавши матеріал параграфа, ви зможете
• пояснювати сутність закону збереження маси речовин, рівнянь хімічних реакцій.
Хімічні реакції, як вам уже відомо з § 16, пов’язані зі зміною хімічного складу речовин. Тому важливо не лише вміти спостерігати та описувати зовнішні ознаки перебігу хімічних реакцій, а й пояснювати ці явища на рівні атомів і молекул.
Для з’ясування того, що відбувається з атомами під час хімічних перетворень, розглянемо реакцію синтезу води з простих речовин - кисню й водню. Для перебігу цієї реакції потрібно створити певні умови: підпалити суміш газів. Експериментально було встановлено найпростіші співвідношення між кількостями реагентів і продуктів цієї реакції. Реагенти - дві молекули водню та молекула кисню. Продукт реакції - дві молекули води (рис. 18.1.1). На схемі зображено одиничний акт реакції, який простим оком побачити неможливо. Для того щоб спостерігати зовнішні ефекти реакції (рис. 18.1.2), потрібні досить значні к ількості речовин.
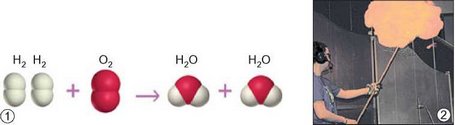
Рис. 18.1. Синтез води (слово «синтез» походить від грец. стйубєощ - сполучення, складання й означає «з’єднувати», «сполучати»). 1. Опис реакції між киснем і воднем на молекулярному рівні. 2. Зовнішній ефект вибуху воднево-кисневої суміші
Причини спостережуваних явищ макросвіту криються у процесах, які відбуваються на рівні зміни об’єктів мікросвіту.
ЦікаВо і пізнаВально
Макросвіт є світом матеріальних об’єктів, що за масштабами можуть бути порівнянні з людськими параметрами й самою людиною. Мікросвіт - це молекули, атоми, елементарні частинки - світ дуже малих об’єктів, які простим оком побачити неможливо.
Аналізуючи зовнішні ефекти хімічних реакцій, можна дійти певних висновків щодо відповідних змін на мікрорівні. Склад молекули води було підтверджено не лише її синтезом з простих речовин, а й аналізом. Унаслідок розкладання води електричним струмом утворюються кисень і водень в об’ємному співвідношенні 1 : 2 (рис. 18.2).

Рис. 18.2. Метод визначення складу речовин шляхом їхнього розкладання на простіші компоненти називають аналізом - від грец. ауаАисті^ - розкладання. Аналіз води. Якою літерою на рисунку 18.2 позначено пробірку, в якій збирається кисень?
Зі схеми (рис. 18.1.1) видно, що під час хімічних реакцій атоми зберігаються. Відбувається лише їхнє перегрупування, унаслідок чого з одних речовин утворюються інші.
Закон збереження маси речовин. Оскільки під час хімічних реакцій атоми зберігаються, то їхня маса також зберігається. Щоб перевірити цю гіпотезу, виконаємо дослід. Зрівноважимо терези, на одній шальці яких стоять посудини з водними розчинами калій йодиду і плюмбум(ІІ) нітрату (рис. 18.3). Після змішування розчинів і утворення яскраво-жовтого осаду терези залишилися зрівноваженими. Отже, наша гіпотеза справдилася, і можна стверджувати, що маса реагентів дорівнює масі продуктів реакції.

Та на основі одного досліду узагальнення робити не можна. Подібне дослідження реакції крейди з кислотою приведе нас до іншого висновку.
Матимемо підстави стверджувати, що маса речовин зменшилася. Адже вуглекислий газ залишив сферу реакції. Натомість маси продуктів прожарювання металів більші за маси металів, узятих для реакцій. Такого висновку ще в XVII столітті дійшов англійський науковець Роберт Бойль.
Яка ж з гіпотезправильна і як це довести? Виявилося, що досить змінити одну з умов експерименту. А саме - проводити досліди в закритих посудинах.

Такий підхід дав змогу М.В. Ломоносову (рис. 18.4) у звіті про лабораторні заняття за 1756 рік записати: «...Роблено досліди в заплавле-них міцно скляних посудинах, щоб дослідити, чи прибуває вага металів від чистого жару; цими дослідами встановлено, що славного Роберта Бойля думка хибна, бо без пропускання зовнішнього повітря вага спаленого металу залишається в тій самій мірі». На жаль, ці спостереження не були вчасно оприлюднені й лише згодом стали надбанням наукової спільноти.
Рис. 18.4. Ломоносов Михайло Васильович (1711-1765) -російський науковець-енциклопедист. Засновник Московського університету. Розробляв атомістичну теорію, відкрив закон збереження маси речовин під час хімічних реакцій
А. Лавуазьє власноруч виконав багато дослідів із прожарювання металів і складних речовин у закритих посудинах (рис. 18.5). Також він ретельно проаналізував експериментальні дані, одержані іншими науковцями. А. Лавуазьє 1789 року сформулював закон збереження маси речовин під час хімічних реакцій.

Рис. 18.5. 1. А. Лавуазьє пояснює колегам знаменитий «дванадцятиденний дослід». Науковець нагрівав ртуть у запаяній реторті, де вона перетворювалася на меркурій(ІІ) оксид, сполучаючись із киснем. За допомогою точного зважування Лавуазьє виявив, що маса меркурій(ІІ) оксиду дорівнює масі ртуті й кисню. Він не лише синтезував меркурій(ІІ) оксид, а й здійснив його аналіз, який підтвердив, що маса реагентів дорівнює масі продуктів реакції. 2. Схематичне зображення приладу, який використовував А. Лавуазьє. Рисунок Марїї-Анни Лавуазьє
Сучасне формулювання цього закону таке: маса реагентів дорівнює масі продуктів реакції.
Кількісний підхід до вивчення речовин і явищ. У його непересічному значенні в науковому пізнанні ви пересвідчилися на конкретних прикладах. І дійшли висновку: під час хімічних реакцій атоми не зникають і не виникають з нічого. Загальна кількість атомів у хімічній реакції не змінюється. Маса кожного атома також залишається сталою. Тому й загальна маса речовин не змінюється.
Відкриття закону збереження маси речовин під час хімічних реакцій сприяло подальшому розвитку хімічної науки і виробництва, розумінню законів природи та зв’язку між ними. Як застосовують закон збереження маси під час складання рівнянь хімічних реакцій, ви дізнаєтеся з наступного параграфа.
ПРО ГОЛОВНЕ
Суть хімічної реакції полягає в перегрупуванні атомів. Під час хімічних реакцій атоми не зникають і не виникають з нічого.
Загальна кількість атомів у хімічній реакції не змінюється. Маса кожного атома також залишається сталою. Тому й загальна маса речовин не змінюється.
Дослідники на основі виявлених закономірностей формулюють їхній словесний або математичний вираз - науковий закон. Закон є формою наукових знань.
Відкриття закону збереження маси сприяло подальшому розвитку хімічної науки і виробництва, розумінню законів природи та зв’язку між ними.
Перевірте себе
1. Чи зберігаються атоми й молекули під час хімічних перетворень?
2. Чи змінюється загальна кількість атомів у хімічній реакції?
3. У чому полягає суть хімічної реакції?
4. Що таке аналіз? Синтез?
5. Як перевіряють гіпотези?
6. Хто відкрив закон збереження маси речовин під час хімічних реакцій?
7. Яке сучасне формулювання закону збереження маси?
8. Яке значення мало відкриття закону збереження маси речовин під час хімічних реакцій?
Застосуйте свої знання й уміння
9. Чому важливо не лише вміти спостерігати та описувати зовнішні ознаки перебігу хімічних реакцій, а й пояснювати ці явища на рівні структурних одиниць речовин?
10. Чому для спостереження зовнішніх ефектів реакцій потрібно використовувати для її проведення досить значні кількості речовин?
11. Чому аналіз потрібно підтверджувати синтезом і навпаки?
12. Чому під час хімічних реакцій маса реагентів дорівнює масі продуктів реакції?
13. Чому потрібно вивчати речовини та їхні перетворення не лише на якісному, а й на кількісному рівні?
14. Чому важливо оприлюднювати результати наукової діяльності?
15. Чим подібні й чим відрізнялися методики проведення дослідів із прожарювання металів, застосовані Р. Бойлем, М. Ломоносовим, А. Лавуазьє?
16. Чим аналіз відрізняється від синтезу?
17*. На платформі електронних терезів стоїть посудина з прозорою вапняною водою. Із часом вода стає каламутною, а покази терезів свідчать про збільшення маси об’єкта. Доведіть, що результати досліду не суперечать закону збереження маси речовин. Запропонуйте, як змінити методику проведення досліду, щоб підтвердити правильність закону збереження маси речовин під час хімічних реакцій.
18. На терезах зрівноважено дві закриті посудини Ландольта (рис. 18.6). Унаслідок нахилення посудини відбувається змішування реактивів, які були в її різних колінах. Спрогнозуйте покази терезів, якщо змішали реактиви: а) лише у лівій посудині; б) в обох посудинах одночасно; в) спочатку у правій, потім - у лівій посудині.
19. Роздивіться рисунок 18.7 та опишіть за ним дослід, який ілюструє закон збереження маси речовин під час хімічних реакцій.

Творча майстерня
20. Підготуйте презентацію про історію відкриття закону збереження маси речовин і його значення.
Дізнайтеся більше про закон збереження маси речовин (с. 179).
Це матеріал з підручника Хімія 7 клас Лашевська
Автор: admin от 12-02-2017, 11:41, Переглядів: 3122