Урок 16. Розв’язування задач
Мета: узагальнити та систематизувати знання про хімічні формули, про якісний та кількісний склад речовин; розвивати навички розв’язання задач з використанням масової частки елемента в речовині; ознайомити зі способами визначення формул речовин за даними про масові частки елементів (за бажанням учителя).
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
Базові поняття та терміни: відносна формульна та відносна молекулярна маси, масова частка елемента, хімічна формула.
Тип уроку: закріплення та корекція знань і навичок.
Методи навчання: пояснювально-ілюстративні; практичні: розв’язування задач; репродуктивні, частково-пошукові.
Структура уроку
I. організаційний момент 2 хв
II. Перевірка домашнього завдання 3 хв
III. Актуалізація опорних знань 3 хв
IV. Узагальнення та систематизація знань 35 хв
V. Домашнє завдання 1 хв
VI. Підбиття підсумків уроку 1 хв
ХІД уроку
I. організаційний момент
Привітання, налаштування на робочий настрій. Учитель називає тему уроку, його план і мету.
II. перевірка домашнього завдання
Перевірка виконання письмових домашніх завдань (усно або на дошці). Кілька зошитів з домашнім завданням можна доручити перевірити учню-експерту.
III. актуалізація опорних знань
; Бесіда
— Дайте визначення поняттю «масова частка елемента в речовині»? Як її обчислюють?
— Запишіть формули для обчислення масової частки елемента та маси елемента.
— Які величини необхідно знати для обчислення масової частки елемента за хімічною формулою?
— Як визначити відносну атомну масу?
— За якими даними записують хімічні формули?
♦ Методична порада
На матеріалі задач цього типу пропонуємо ознайомити учнів з мінералами. Ілюстрації до задач можна знайти на сайті: http://www.catalogmineralov.ru/. Варто зазначити, що мінералогія є розділом геології.
; Розв'язання задач з використанням поняття «масова частка елемента»
Роботу можна організувати в різні способи:
1) фронтальна робота: два учні розв’язують подібні задачі (а і б) біля дошки;
2) фронтальна робота: один учень біля дошки розв’язує задачу, позначену літерою а, усі учні розв’язують задачу, позначену літерою б, результати обговорюються, розв’язання порівнюється;
3) робота в групах (організовується дві або чотири групи). Групи, які першими розв’язують одну з подібних задач, демонструють розв’язання на дошці, результати та способи розв’язання обговорюються. Умови всіх задач роздаються на кожну парту.
Обчислення масової частки елемента
Задача 1. а) Малахіт — крихкий мінерал зеленого кольору, має формулу СиС03(0Н)2. Його вважають російським каменем, оскільки слава його почалась із 1635 р. після відкриття уральських малахітових рудників, які сьогодні майже повністю вичерпані. Визначте масову частку всіх елементів у цій сполуці.
б) Смарагд — камінь зеленого кольору, має формулу Ве3А12^Ю3)6. У смарагдову чашу, за біблейською легендою, зібрали кров Христа. Римський імператор Нерон через смарагдовий монокль спостерігав палаючий Рим. Визначте масову частку всіх елементів у цій сполуці.
Задача 2. Порівняйте масову частку Оксигену в малахіті та в смарагді.
Задача 3. а) Бірюза має блакитний колір завдяки наявності в цій сполуці йонів Купруму. Бірюза хімічно нестійка: поглинає вологу, всмоктує жири, «боїться» сонця, взаємодіє з вуглекислим газом, набуваючи зеленого кольору. Камінчик масою 208 г містить 16 г атомів Купруму. Обчислить масову частку Купруму в бірюзі.
б) Рубін, який у Стародавній Індії називали царем коштовних каменів,— різновид мінералу корунду (А1203). Його червоний колір зумовлюють домішки атомів Хрому. Кристал рубіну масою
167 г містить 15 г атомів Хрому. Обчисліть масову частку Хрому в цьому кристалі.
Обчислення маси елемента за відомою масовою часткою Задача 1. а) Гематит — напівкоштовний камінь із кольором від чорного до червоного, відомий ще в Стародавньому Єгипті. Масова частка Феруму в ньому становить 0,7. Обчисліть масу Феруму в камінчику гематиту масою 50 г.
б) Зелений колір смарагдів зумовлений наявністю в них домішок елемента Хрому з масовою часткою 0,14 %. Найбільшим з не-оброблених смарагдів вважається смарагд знайдений в Україні (Волинь) у 1970 р. Його маса становить 5360 г. Обчисліть масу атомів Хрому в цьому кристалі.
Задача 2. а) Мінерал сильвін, що має хімічну формулу КС1, використовують як калійне добриво. Обчисліть масу атомів Калію, що міститься в 50 г сильвіну.
б) Гірський кришталь — це кристалічний, прозорий, безкольоровий кварц із хімічною формулою SiO2. У Стародавній Греції вважали, що це закам’яніла кришталева вода, яка зовсім утратила тепло. Яка маса атомів Силіцію міститься в кристалі гірського кришталю масою 200 г.
Обчислення маси сполуки за відомою масовою часткою елемента
1. Сапфіри синього кольору здавна були «королівськими каменями» — символами мудрості, влади, перемоги. Це різновид корунду з масовою часткою Алюмінію 52,9 % та домішками Титану й Феруму. Обчисліть масу кристала сапфіру, в якому міститься 5,4 г атомів Алюмінію.
2. Мармур, вапняк, кальцит і крейда є різновидами сполуки з хімічною формулою СаС03. Визначте, у якій масі цієї сполуки міститься 120 г атомів Карбону.
Визначення формул речовин за даними про масові частки елементів (матеріал викладається на розсуд учителя)
Цей тип задач розглядається як додатковий матеріал на розсуд учителя та залежно від особливостей класу. Учитель демонструє способи розв’язання, а подібні задачі можуть бути додатковим домашнім завданням.
1) Мінерал пірит є рудою, з якої отримують залізо. Він містить 47 % Феруму і 53 % Сульфуру. Відносна формульна маса піриту дорівнює 120. Визначте формулу піриту.
Розв’язання:
Якщо відома масова частка одного елемента і відносна формуль-на маса, то можна визначити кількість атомів за формулою:
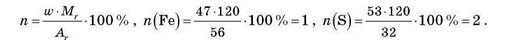
Відповідь: формула піриту FeS2.
2) Визначте формулу гематиту — сполуки Феруму з Оксигеном, у якому масова частка Феруму становить 70 %.
Розв’язання:
Якщо відома масова частка одного елемента, то можна визначити відносну молекулярну масу речовини:
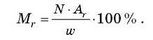
Якщо в молекулі міститься один атом Феруму, тоді відносна молекулярна маса дорівнює:

Приклади задач для самостійного розв’язання
1. Визначте формулу етану, якщо відомо, що у його складі міститься 80 % Карбону і 20 % Гідрогену. Його відносна молекулярна маса дорівнює 30.
2. Визначте формулу сполуки Сульфуру з Оксигеном, у якій масова частка Оксигену становить 50 %.
3. Визначте формулу корунду — сполуки Алюмінію з Оксигеном, у якому масова частка Оксигену становить 47 %.
; Розповідь учителя
Інформація, яку містить хімічна формула
Учитель нагадує, що кожна речовина має свою, властиву тільки їй формулу, яка відображає її якісний і кількісний склад. За
формулою сполуки складають її назву. Крім того, за формулою речовини визначають її відносну формульну масу та масову частку елементів у сполуці.
Учитель пропонує план для опису речовини за її формулою:
1. Якісний склад речовини (елементи, які її утворюють).
2. Кількісний склад (кількість атомів кожного елемента у фор-
мульній одиниці).
3. Співвідношення атомів різних елементів у речовині.
4. Відносна формульна маса.
5. Масова частка елементів у сполуці.
; Самостійна робота
Ця самостійна робота проводиться з метою перевірки та корекції набутих умінь і навичок, тому обов’язково оцінюється. Пропонуємо таку шкалу оцінювання:
Перше завдання є обов’язковим й індивідуальним і оцінюється у 8 балів.
Друге завдання учень обирає з двох різних рівнів, що оцінюються додатково в +2 бали або +4 бали відповідно до складності обраного завдання. Ці завдання можуть бути подані на індивідуальних картках, які вчитель роздає учням після виконання першого завдання, або надруковані для кожної парти у вигляді переліку, з якого учні обирають одну задачу для виконання (при цьому слід попередити, що сусідам не можна обирати однакові завдання).
Завдання 1. Запишіть інформацію, яку можна визначити за хімічною формулою речовини.
(Учням роздаються індивідуальні картки з формулами речовини.)
Приклади формул:
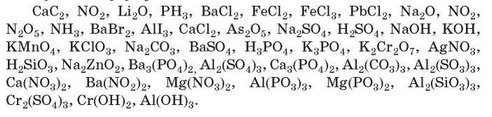
Завдання 2. Приклади завдань (на вибір):
І рівень (+2 бали)
1. Обчисліть, що важче: 5 молекул чадного газу СО чи 2 молекули сірчистого газу SO2.
2. У якій із цих сполук — С12О3 чи С12О7 — масова частка Хлору менша?
3. У якій із цих сполук — С02 чи SO2 — масова частка Оксигену більша?
4. У якій із цих сполук — Р205 чи Р203 — масова частка Фосфору менша?
5. Формула глюкози С6Н1206, формула сахарози С12Н22011. У якій речовині масова частка Оксигену більша?
6. Ферум утворює з Оксигеном сполуки FеO, Fe2Oз, FeзO4. Визначте, у якій сполуці масова частка Феруму найбільша.
7. Масова частка Гідрогену у воді становить 11 %. Яка маса атомів Гідрогену міститься у воді масою 100 г?
8. Масова частка Ауруму в ювелірному золоті становить 0,583. Обчисліть масу атомів Ауруму, що міститься в золотому ланцюжку масою 3,5 г.
9. Масова частка Купруму в сполуці з Оксигеном становить 0,8. Обчисліть масу атомів Купруму в цій сполуці масою 200 г.
10. Обчисліть масу кристала певної сполуки, у якому міститься 80 г атомів Оксигену, якщо масова частка Оксигену в ній становить 48 %.
11 рівень (+4 бали)
1. Обчисліть масу атомів Гідрогену, що містяться в амоніаку NHз масою 10 г.
2. Маса води на Землі оцінюється такою, що приблизно дорівнює 1,451018 т. Обчисліть, яка маса атомів Гідрогену й Оксигену міститься в цій масі води.
3. Обчисліть масу атомів Оксигену, які містяться в одній склянці води (200 г).
4. Обчисліть масу атомів Сульфуру, що міститься в 50 г сульфатної кислоти, яка має формулу Н^04.
5. Визначте, у якій масі глюкози, що має формулу С6Н1206 міститься 16 г атомів Оксигену.
6. Обчисліть масу атомів Натрію, що міститься в 20 г питної соди, яка має формулу ^НС03.
7. Визначте формулу сполуки, якщо відомо що у її складі міститься Магній з масовою часткою 60 % і Оксиген з масовою часткою 40 %, а відносна формульна маса дорівнює 40.
8. Визначте формулу сполуки, якщо відомо, що у її складі міститься Кальцій, Карбон і Оксиген з масовими частками 40 %,
12 %, 48 % відповідно, а відносна формульна маса сполуки дорівнює 100.
9. Визначте формулу сполуки Сульфуру з Оксигеном, у якій масова частка Оксигену становить 60 %.
10. Визначте формулу сполуки Карбону з Оксигеном, у якій масова частка Оксигену становить 72 %.
V. домашнє завдання
1. Прочитати параграф підручника.
2. Знайти цікаву інформацію про коштовні камені (легенди, історичні факти, вплив на здоров’я, долю, талісмани). Можна запропонувати виконати проект на цю тему.
VI. підбиття підсумків уроку
Учитель робить висновки, щодо навчальних досягнень учнів при розв’язуванні задач із використанням поняття «масова частка елемента».
Учитель пропонує учням висловитися, чи був урок корисним, яку цікаву інформацію отримано.
Автор: admin от 21-01-2017, 00:15, Переглядів: 5511