Урок 12. Маса атома. Відносна атомна маса
Мета: сформувати поняття про атомну одиницю маси та відносну атомну масу; сформувати поняття про відмінність термінів «маса атома» та «відносна атомна маса»; сформувати навички порівнювати значення відносних атомних мас хімічних елементів.
Обладнання та матеріали: Періодична система хімічних елементів Д. І. Менделєєва.
Базові поняття та терміни: хімічний елемент, атом, атомна одиниця маси, відносна атомна маса.
Тип уроку: комбінований.
Методи навчання: пояснювально-ілюстративні: бесіда, розповідь; репродуктивні, частково-пошукові, дослідницькі, практичні: розв’язування
задач.
Структура уроку
I. Організаційний момент 1 хв
II. Перевірка домашнього завдання 12 хв
III. Актуалізація опорних знань 3 хв
IV. Вивчення нового матеріалу 15 хв
1. Маса атома.
2. Атомна одиниця маси.
3. Відносна атомна маса.
V. Закріплення знань 11 хв
VI. Домашнє завдання 1 хв
VII. Підбиття підсумків уроку 2 хв
ХІД УРОКУ
I. організаційний момент
II. перевірка домашнього завдання
Бесіда
Проводиться бесіда за усними запитаннями до параграфа з минулого уроку.
Перевірка виконання письмових завдань
Проводиться усно або на дошці.
Учні, які виконували додаткове домашнє завдання, читають свої повідомлення, відповідають на уточнюючі запитання.
Робота за картками
Деякі учні отримують індивідуальні картки із завданнями, які вони виконують біля дошки або на робочому місці в зошитах.
1. Запишіть за допомогою хімічних символів і цифр: а) три молекули водню; б) п’ять атомів Хлору; в) дві молекули сірки, кожна з яких складається з восьми атомів Сульфуру; г) чотири молекули води; д) дві молекули нітратної кислоти, кожна з яких складається з одного атома Гідрогену, одного атома Нітрогену та трьох атомів Оксигену.
2. Що означають записи: 5^, 4F2, 3С02, 3Н20, 5Н^?
III. актуалізація опорних знань
[ Бесіда
— Дайте визначення поняттю «атом».
— Як за допомогою Періодичної системи описати хімічний елемент?
— Визначте місце в Періодичній системі таких хімічних елементів: Карбон, Нітроген, Кальцій.
І Мотивація
У клітинці кожного хімічного елемента в Періодичній системі є ще одна дуже важлива цифра, вона показує масу атома.
(Учитель показує приклади в таблиці.)
— Як ви вважаєте, в яких одиницях наведена маса в таблиці?
Учитель провокує учнів:
Чи може маса атома Аргентуму дорівнювати, наприклад 107,8 г? Діти висловлюють свої міркування.
Учитель формулює тему уроку.
Цілепокладання
Учні формулюють запитання, які слід розглянути на уроці, щоб вирішити проблему щодо маси атомів хімічних елементів, яка наведена в Періодичній системі.
IV. вивчення нового матеріалу
1. Маса атома Розповідь учителя
Атоми — надзвичайно маленькі частинки. Вони, як і всі матеріальні частинки речовини, мають масу, але дуже маленьку. Майже вся маса атома сконцентрована в ядрі, маса електронів набагато менша, і нею зазвичай нехтують. Маси атомів такі малі, що виражати їх у грамах або кілограмах дуже незручно. Так, маса атома Гідрогену (найлегшого атома в природі) приблизно дорівнює 0,000000000000000000000001673 г або 1,673 • 10-24 г. Маса навіть найважчих атомів становить близько 10-22 г, тобто 0,0000000000000000000001. Тому зручніше виражати масу атомів, порівнюючи її з якою-небудь маленькою величиною. Сьогодні використовують відносні атомні маси — фізичні величини, що показують, у скільки разів маси атомів хімічних елементів більші за певну величину, яку називають атомною одиницею маси.
Для пояснення можна навести приклад з торгівлі. Підприємці завозять на ринок товар, наприклад картоплю, машинами, а покупці купують картоплю мішками або відрами. Це й будуть своєрідні одиниці вимірювання маси картоплі, більш зручні для покупців.
2. Атомна одиниця маси ; Розповідь учителя
Спочатку за атомну одиницю маси приймали масу найменшого атома — атома Гідрогену. У сучасній хімії маси атомів порівнюють із 1/12 маси атома Карбону. Ця одиниця вимірювання називається атомною одиницею маси (а. о. м.). Маса атома Карбону становить 1,99 • 10-23 г, отже, атомна одиниця маси дорівнює:
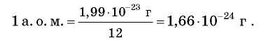
Робимо висновок: 1 атомна одиниця маси — це 1/12 маси атома Карбону.
1 а. о. м. = 1,66 • 10-24 г (це приблизно дорівнює масі атома Гідрогену).
3. Відносна атомна маса ; Розповідь учителя
Частіше використовують відносні атомні маси, які визначають, порівнюючи маси атомів з 1 а. о. м., з’ясовуючи, наскільки вони важчі за 1/12 маси атома Карбону. Масу атома, визначену порівнянням з атомною одиницею маси, називають відносною атомною масою і позначають Ar (індекс r — від англ. relative — відносний). Відносна атомна маса — величина безрозмірна, оскільки показує, у скільки разів атом важчий за атомну одиницю маси.
Відносна атомна маса — це відношення маси атома даного елемента до 1/12 маси атома Карбону.
Відносні атомні маси хімічних елементів обчислюються діленням мас відповідних атомів на атомну одиницю маси. Наприклад, маса атома Йоду становить 2,109 • 10-22 г, отже, його відносна атомна маса дорівнює:
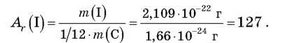
У такий спосіб можна визначити, що відносна атомна маса Гідрогену дорівнює 1,00797 (округлено 1): АГ(Н) = 1, а Оксигену — 15,9994 (округлено 16): Аг(0) = 16. Відносна атомна маса Карбону, обчислена аналогічним чином, дорівнює 12.
Відносна атомна маса Аг показує, у скільки разів маса певного атома більша за 1/12 маси атома Карбону.
Наприклад, ми вже знаємо, що відносна атомна маса Оксигену Аг(0) = 16, отже атом Оксигену в 16 разів важчий за 1/12 маси атома Карбону. Значення АГ(Н) = 1 означає, що маса атома Гідрогену приблизно дорівнює масі 1/12 масі атома Карбону. Відносна атомна маса — це безрозмірна величина, оскільки вона являє собою відношення двох величин з однаковою розмірністю.
Сьогодні відносні атомні маси майже всіх елементів визначені з високою точністю й наведені в Періодичній системі хімічних елементів. До речі, хімічні елементи розташовані в Періодичній системі саме за зростанням відносних атомних мас. Зазвичай точні значення відносних атомних мас, які використовують для хімічних розрахунків, округляють до цілих чисел. (Обов’язково необхідно нагадати учням правила округлення.) Значення відносної атомної маси для Хлору округляють із точністю до десятих: АГ(С1) = 35,5.
V. ЗАКРІПЛЕННЯ ЗНАНЬ І Бесіда
— Повернемося до проблеми, що розглядалася на початку вивчення нового матеріалу: в яких одиницях наведена маса атомів у таблиці Д. І. Менделєєва?
— Що вона показує?
— Дайте визначення поняттю «відносна атомна маса». Що в даному випадку означає слово «відносна»?
— Для чого використовується атомна одиниця маси?
— Чому масу атомів рідко виражають у грамах?
Завдання для закріплення знань
1. Знайдіть у Періодичній системі та випишіть символи й відносні атомні маси (з округленням до цілих чисел) хімічних елементів: Алюмінію, Флуору, Цинку, Аргентуму, Калію.
2. Визначте, у скільки разів відрізняються відносні атомні маси: а) Карбону й Оксигену; б) Нітрогену й Ауруму.
3. Обчисліть, атом якого елемента важчий і в скільки разів: а) Нітроген і Гелій; б) Оксиген і Сульфур; в) Ферум і Силіцій; г) Суль-фур і Купрум.
4. Обчисліть масу атома Магнію в грамах.
VI. ДОМАШНЄ ЗАВДАННЯ
1. Прочитати параграф підручника.
2. Відповісти на запитання після параграфа, виконати завдання.
3. Підготуватися до контролю знань.
4 . Підготувати повідомлення за темою «Як у XVII-XIX століттях визначали відносну атомну масу (атомну вагу)? Маси яких елементів були узяті за основу для визначення відносних атомних мас? Чому в сучасній хімії для визначення відносних атомних мас використовується карбонова одиниця?».
VII. ПІДБИТТЯ Підсумків уроку
Учні підбивають підсумок: що вивчили на уроці, що навчились робити. Чим може бути корисною Періодична система хімічних елементів?
Автор: admin от 21-01-2017, 00:04, Переглядів: 4683