Взаимодействие воды с оксидами
Понятие о кислотах и основаниях
Многие оксиды способны вступать в химические реакции с водой. Обычно эти реакции являются реакциями соединения, в результате которых образуются продукты присоединения воды к оксидам. Вещества, образующиеся путем соединения воды с другими веществами, называют гидратами.
В зависимости от того, с каким оксидом взаимодействует вода, может образоваться два типа гидратов: кислоты и основания. Кислоты состоят из атомов Гидрогена и кислотного остатка (H2SO4, ^ТОд), а в формулах оснований на первое место записывают металлический элемент, с которым соединяется гидроксильная группа — ОН (KOH, Ba(OH)2). В зависимости от гидрата, соответствующему определенному оксиду, среди оксидов выделяют две группы: кислотные оксиды. и основные оксиды.
Кислотные оксиды
Все кислотные оксиды, за исключением силиций(^) оксида SiО2, в обычных условиях вступают в реакции соединения с водой с образованием кислот:

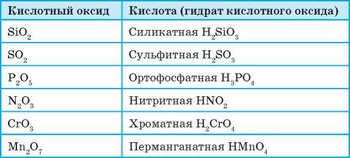
Оксиды, гидраты которых являются кислотами, называют кислотными оксидами.
Большинство кислотных оксидов — это оксиды неметаллических элементов. Но кислотные оксиды могут образовывать и металлические элементы, если эти элементы могут проявлять высокие валентности, выше четырех. Так, к кислотным оксидам относится хром(У1) оксид Сг03 и манган(УП) оксид Мп207.
Формулы наиболее употребляемых кислотных оксидов и соответствующих им кислот приведены в таблице 5.
Основные оксиды
Продукты реакции оксидов с водой (гидраты) могут проявлять основные свойства. Если гидрат оксида является основанием, то такой оксид — основный.
Оксиды, гидраты которых являются основаниями, называют основными оксидами.
К основным оксидам относятся оксиды металлических элементов. Это, как правило, оксиды одно-, дву-, а иногда трехвалентных металлических элементов (табл. 6).
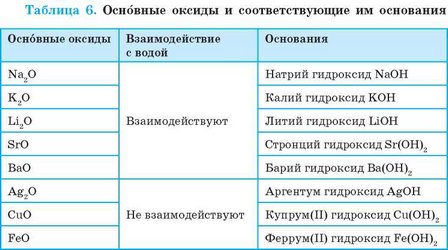
Большинство основных оксидов с водой не взаимодействуют. В реакцию с водой вступают лишь оксиды, гидраты которых растворяются в воде (см. табл. 6, с. 161). Такие гидраты называют щелочами:
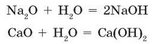
• Единственный кислотный оксид, который в обычных условиях не взаимодействует с водой,— это силиций(1У) оксид SiO2, которому соответствует силикатная кислота H2SiO3. Он широко распространен в природе в составе минерала кварца. Обычный кварцевый песок на берегах морей и рек — это и есть силиций(1У) оксид.
• При взаимодействии кальций оксида (негашеной извести) с водой образуется кальций гидроксид (гашеная известь). Во время этой реакции выделяется так много теплоты, что вода может закипеть. Эту реакцию используют в так называемых химических грелках для разогревания завтраков или напитков в одноразовых пакетах.
Выявление кислот и оснований в растворах
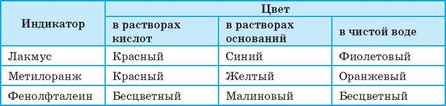
Большинство оксидов и соответствующих им гидратов — бесцветные соединения, поэтому выявить их наличие или различить кислоты и основания без «посторонней помощи» невозможно. Для выявления кислот и оснований в растворах используют индикаторы — сложные органические соединения, которые изменяют свою окраску в зависимости от наличия кислоты или основания в растворе (рис. 114). Наиболее употребляемые индикаторы и их цвет при наличии кислот и оснований приведены в таблице 7.
Таблица 7. Цвет некоторых индикаторов при наличии кислот, оснований и в воде
Чаще всего индикаторы используют в виде растворов — в воде или спирте. Удобнее использовать индикаторную бумагу — обычную бумагу, пропитанную раствором индикатора (рис. 115).

ЛАБОРАТОРНЫЙ ОПЫТ № 5
Испытание водных растворов кислот и щелочей индикаторами
Оборудование: штатив с пробирками.
Реактивы: растворы основания, кислоты, вода, метилоранж, фенолфталеин, лакмус.
Правила безопасности:
• для опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза.
1. Подготовьте по три пробирки с водой, раствором кислоты и раствором основания.
2. В первую пробирку с водой добавьте несколько капель раствора метилоранжа, во вторую — лакмуса, в третью — фенолфталеина.
3. Добавьте индикаторы к растворам кислоты и основания.
4. Сравните цвет индикаторов в разных пробирках. Запишите результаты в тетрадь.
Выводы:
1. Оксиды способны соединяться с водой с образованием гидратов. Гидраты кислотных оксидов — кислоты, а основных — основания.
2. К кислотным оксидам относятся оксиды неметаллических элементов и оксиды металлических элементов с валентностью выше IV. К основным оксидам относятся оксиды металлических элементов с валентностью I, II и иногда 111.
3. Для выявления кислот и оснований в растворе используют индикаторы — вещества, цвет которых изменяется при наличии кислоты или основания.
Контрольные вопросы
1. Какие оксиды называют кислотными, а какие — основными?
2. Какие вещества называют гидратами?
3. Какие оксиды (кислотные и основные) в обычных условиях взаимодействуют с водой, а какие — нет?
Задания для усвоения материала
1. Приведите уравнения реакций кислотных и основных оксидов с водой.
2. Из приведенного перечня выпишите отдельно формулы оксидов: а) кислотных; б) основных. №20, Р205, С02, SO3, СгО, Си20, SiО2, Мп207.
3. Какие из приведенных оксидов взаимодействуют с водой? Составьте соответствующие уравнения реакций. №20, С02, SO3, СгО, SiО2.
4. Раствор, который образовался при растворении газообразного оксида в воде, окрашивает лакмус в красный цвет. Какой это газ мог бы быть? Составьте уравнения реакций.
5. Гашение извести — это взаимодействие негашеной извести (кальций оксида) с водой. Составьте уравнение этой реакции.
6. Как вы считаете, существуют ли в природных условиях фосфор(У) оксид, сульфур(У1) оксид и натрий оксид? Ответ обоснуйте.
7. Дополните схемы реакций и назовите продукты реакции:
а) Ы20 + Н20 ^......; б) SO2 + Н20 ^......; в) ......+ Н20 ^ Ва(ОН)2.
8*. Некоторые оксиды используют как осушители для обезвоживания газов. На каком принципе основано действие оксидов как осушителей? Какие оксиды можно для этого использовать и почему?
Это материал учебника Химия 7 класс Григорович
Автор: admin от 19-01-2017, 03:30, Переглядів: 21696