Уравнения химических реакций. Закон сохранения массы веществ в химических реакциях
Закон сохранения массы
Все химические превращения удобно описывать посредством химических формул и уравнений реакций. Процесс горения угля можно описать такой схемой:

Эту схематическую запись называют уравнением химической реакции. В левой части уравнения записан один атом Карбона и одна молекула кислорода, которая состоит из двух атомов Оксигена. В правой части уравнения записана одна молекула углекислого газа (карбон(ГУ) оксида), которая состоит из одного атома Карбона и двух атомов Оксигена.

Число атомов каждого химического элемента в обеих частях уравнения одинаково. Для того чтобы подчеркнуть равное число атомов всех элементов, в данной записи стрелку можно заменить на знак равенства:
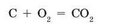
Уравнение химической реакции является отображением закона сохранения массы веществ в химических реакциях.
Масса веществ, которые вступили в химическую реакцию, равна массе веществ, которые образовались в результате реакции.
Этот закон был открыт М. В. Ломоносовым в 1748 году и, независимо от него, А. Лавуазье в 1789 году, поэтому данный закон называют также законом Ломоносова-Лавуазье.
В результате химических реакций одни вещества превращаются в другие: атомы, из которых состоят исходные вещества, не исчезают, не появляются и не превращаются из одного вида в другой, а только перегруппировываются, образуя молекулы новых веществ.
Сегодня это утверждение кажется очевидным, однако в XVII в. наблюдения некоторых ученых противоречили ему. Например, спирт при горении постепенно утрачивает массу и, наконец, исчезает. Если железная пластинка лежит на воздухе, она постепенно ржавеет и ее масса при этом увеличивается. Как это объяснить? Объяснение этим фактам нашли только после проведения экспериментов с тщательным взвешиванием исходных веществ и продуктов реакций.
Докажем, что во время горения закон сохранения массы выполняется. Горение свечи — это химическая реакция, которая происходит с образованием углекислого газа и воды (в виде водяного пара). Продукты реакции (углекислый газ и водяной пар) — это газообразные вещества, которые испаряются, и потому кажется, что вещество исчезает. Если реакцию проводить в закрытом сосуде, то продуктам реакции не будет куда исчезать.
На одну чашу весов поместим горючее вещество в герметично закрытой емкости, заполненной кислородом (рис. 86). Уравновесим весы и подожжем. Вещество некоторое время горит, а потом, когда израсходуется кислород, горение прекращается. Во время горения равновесие весов сохраняется. Таким образом, масса колбы с исходными веществами равна массе колбы с продуктами реакции.
В случае ржавления железа атомы Феррума реагируют с кислородом и водой из окружающего воздуха. В этом случае образуется ржавчина, масса которой больше, чем масса исходного железа, поэтому кажется, что вещество возникает ниоткуда.

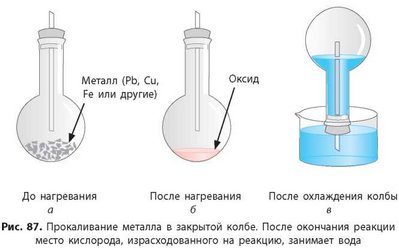
Проведем подобный опыт в герметичной колбе (рис. 87а). Поместим образец металла в колбу, закроем ее пробкой с запаянной газоотводной трубкой и нагреем. После прокаливания металл изменяет свой цвет, так как он превратился в оксид (рис. 876). Чтобы доказать, что часть воздуха израсходовалась на реакцию с металлом, опустим газоотводную трубку в емкость с водой и откроем конец трубки. Поскольку часть воздуха соединилась с металлом, то в колбе возникло свободное пространство, которое через трубку заполняет вода (рис. 87е).
Выдающийся российский ученый. Учился в Словя-но-греко-латинской академии, в Киево-Могилянской академии, Петербургском университете, в университете Гамбурга. Ломоносов был одним из образованнейших людей России того времени. Заслуживают внимания его труды не только в области химии, но и в минералогии, географии, металлургии, физике, истории, поэзии, изобразительном искусстве. Открыл закон сохранения массы, создал первую в России химическую лабораторию. По результатам наблюдений солнечного затмения установил существование атмосферы на Венере. По его инициативе был открыт Московский университет, который сегодня носит его имя.

Уравнения химических реакций составляются с учетом закона сохранения массы. Рассмотрим, как составляются уравнения реакций образования бинарных соединений из простых веществ.
Пример 1. Составим уравнение реакции образования метана СН4 — основного компонента природного газа. Метан состоит из атомов Карбона и Гидрогена. Таким образом, для его получения необходимы простые вещества, одно из которых состоит из атомов Карбона (уголь С), а другое — из атомов Гидрогена (водород Н2).
В левой части записываем исходные вещества (реагенты) С и Н2, а в правой — продукт реакции СН4:
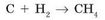
Но эта запись еще не является уравнением реакции — это схема реакции. Для того чтобы она превратилась в уравнение, необходимо уравнять число атомов каждого элемента в левой и правой частях. Для этого необходимо подобрать коэффициенты — цифры перед химическими формулами, которые указывают число молекул (атомов). Как видно, в левой и правой частях схемы по одному атому Карбона, но в левой части два атома Гидрогена (одна молекула водорода), а в правой — четыре атома (в составе одной молекулы метана). Это противоречит закону сохранения массы. Чтобы это исправить, перед формулой водорода в левой части уравнения нужно поставить коэффициент 2:
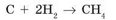
Теперь в обеих частях уравнения число атомов Гидрогена и Карбона одинаково, поэтому стрелку между реагентами и продуктами в уравнении можно заменить знаком равенства:
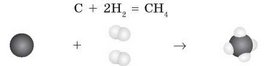
Пример 2. Рассмотрим реакцию горения метана. Горение — это взаимодействие с кислородом 02. При горении метана образуются углекислый газ С02 и вода Н20.
Запишем схему реакции:
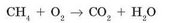
Теперь необходимо уравнять число атомов каждого химического элемента, т. е. подобрать коэффициенты. Начнем с атомов Карбона:
в обеих частях уравнения их по одному. Потом подсчитаем атомы Гидрогена: в левой части четыре атома, а в правой — два. Чтобы уравнять их число, нужно перед формулой воды поставить коэффициент 2:
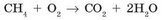
Осталось уравнять число атомов Оксигена (обычно Оксиген уравнивают последним). В левой части уравнения два атома Оксигена в молекуле 02, а в правой — четыре (два атома в составе молекулы углекислого газа С02 и два атома в составе двух молекул воды Н20). Таким образом, в левой части уравнения перед формулой кислорода необходимо поставить коэффициент 2:
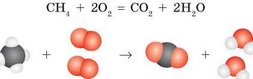
Теперь число атомов всех элементов одинаково, следовательно, коэффициенты подобраны правильно.
Подбирая коэффициенты в уравнении реакции, необходимо помнить следующие правила:
• коэффициент показывает число молекул, отдельных атомов или
формульных единиц в уравнении реакции;
• коэффициент ставится только перед химической формулой;
• коэффициент относится ко всем атомам, из которых состоит
молекула, перед которой он стоит, например:
запись 2Н20 означает две молекулы воды, в которых содержится 4 атома Гидрогена (по два в каждой молекуле) и 2 атома Оксигена (по одному в каждой молекуле);
• коэффициент 1, как и индекс 1, не записывается;
• индекс показывает число атомов элемента (или групп атомов) в составе молекулы, а коэффициент — число молекул, например:
Н — один атом Гидрогена;
2Н — два атома Гидрогена;
Н2 — одна молекула водорода, состоящая из двух атомов Гидрогена;
2Н2 — две молекулы водорода, каждая из которых состоит из двух атомов Гидрогена.
Записи 4Н и 2Н2 неравнозначны. Хотя в них и записано одинаковое число атомов Гидрогена, но первая запись означает четыре отдельных атома Гидрогена, а вторая — две молекулы водорода.
В уравнениях реакций часто указывают условия протекания реакций или выделение газа и осадка. Так, если из раствора выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх: из газов или жидкостей образуется
нерастворимое вещество, то рядом с его формулой ставят стрелку, направленную вниз: І.
Выводы:
1. Массы веществ, вступающих в реакцию, равны массе образованных веществ, о чем свидетельствует закон сохранения массы в химических реакциях. Этот закон основан на том, что атомы в химических реакциях не исчезают, а просто переходят из одних веществ в состав других. Посредством химических символов и знаков закон сохранения массы отображают уравнением химической реакции.
2. При составлении уравнений химических реакций необходимо соблюдать условие, что число атомов всех элементов в левой и правой частях уравнения должно быть одинаковым. Для этого перед химическими формулами пишут коэффициенты, которые обозначают число молекул, отдельных атомов или формульных единиц.
Контрольные вопросы
1. Сформулируйте закон сохранения массы веществ и обоснуйте его с позиции понятий об атомах и молекулах.
2. Почему при горении свечи ее масса постепенно уменьшается? Не противоречит ли это закону сохранения массы?
3. Какую запись называют уравнением химической реакции?
4. Каково значение коэффициентов в уравнении реакции и индексов в химической формуле? В чем заключается отличие между коэффициентом и индексом?
Задания для усвоения материала
1. Объясните, что означают записи:
а) 2Н, О, 4Fe, 3Са, 5^ б) 02, 502, 60, 03, 203; в) 3^0, 5Н2, 2С02, 5С, 3О2.
2. Рассмотрите схематическое изображение химической реакции образования аммиака. Запишите для нее уравнение, если синими шариками обозначены атомы Нитрогена, а красными — Гидрогена.
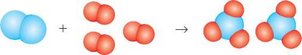

3. Подберите коэффициенты. Если нужно, обозначьте выделение газа или образование нерастворимого вещества соответствующими символами.
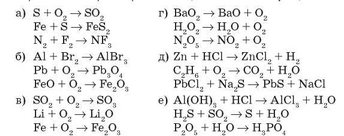
4. Составьте уравнения реакций: а) в результате взаимодействия водорода H2 и кислорода 02 образуется вода Н20; б) железо Fe реагирует с кислородом и водой и покрывается ржавчиной, основной составляющей которой является вещество с формулой Fe(0H)3; в) в результате разложения сахарозы С12Н220л образуются уголь C и вода Н20.
5. На рисунке 88 представлена схема химической реакции взаимодействия лития с водой. Составьте уравнение данной реакции.
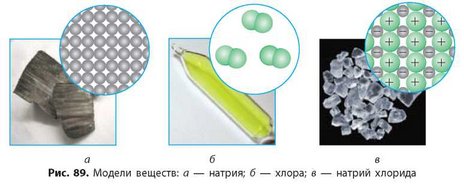
6. На рисунке 89 (с. 121) приведены модели веществ. Составьте уравнение реакции натрия с хлором.
7. В результате взаимодействия серы S массой 16 г с железом Fe образовалось 44 г феррум(М) сульфида FeS. Вычислите массу израсходованного железа.
8. Вследствие взаимодействия метана массой 8 г с кислородом массой 32 г образовался углекислый газ массой 22 г. Вычислите, какая масса воды образовалась в результате этой реакции.
9. Составьте уравнения реакций образования из простых веществ следующих соединений: а) феррум(11) оксид FeO; б) аргентум(1) сульфид Ag2S; в) кальций фосфид Ca3P2; г) алюминий оксид Al2O3; д) фосфор^) оксид P2O5.
Это материал учебника Химия 7 класс Григорович
Автор: admin от 19-01-2017, 03:26, Переглядів: 4063