Валентность
Понятие о валентности
При образовании молекул атомы соединяются не беспорядочно, а в определенной последовательности особыми химическими связями. Каждый атом может образовать не бесконечное, а только определенное число таких связей. В XIX в. ученые установили, что атомы разных элементов имеют разную способность присоединять к себе другие атомы. Так, например, было подмечено, что атом Гидрогена может присоединить только один атом другого химического элемента (HCl, HF, NaH), атом Оксигена — два атома Гидрогена (H2O), атом Нитрогена — три атома Гидрогена (NH3).
Это свойство атомов было названо валентностью.
Валентность — это число связей, которые данный атом может образовать с другими атомами.
Чтобы показать, как атомы соединены в молекуле, используют графические (структурные) формулы. Они показывают не только число атомов в молекуле, но и последовательность их соединения. Графическая формула молекулы воды ИЮ имеет вид:
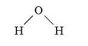
Из этой формулы видно, что в молекуле воды атом Оксигена соединен с двумя атомами Гидрогена, причем атомы Гидрогена друг с другом не связаны. Каждая связь в графической формуле обозначается черточкой. Атом Оксигена образует две связи, следовательно, валентность Оксигена равна двум (Оксиген двухвалентен), а атомы Гидрогена образуют по одной связи — валентность Гидрогена равна единице (Гидроген одновалентен).
Рассмотрим графическую формулу молекулы углекислого газа ТО2:
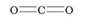
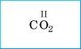
В молекуле углекислого газа атомы Оксигена образуют по две связи с атомом Карбона (такую связь называют двойной), а Карбон в этом случае образует четыре связи (или две двойные связи). В этом соединении валентность Карбона равна четырем.
Некоторые элементы проявляют постоянную валентность — во всех соединениях им присуще только одно определенное значение валентности. Так, Гидроген всегда одновалентен, а Оксиген всегда двухвалентен. Другие элементы могут проявлять различную валентность в разных соединениях. Например, валентность Сульфура может быть равна двум, четырем и шести. О таких элементах говорят, что они проявляют переменную валентность. Для обозначения валентности используют римские цифры.
Таблица 3. Валентность некоторых химических элементов
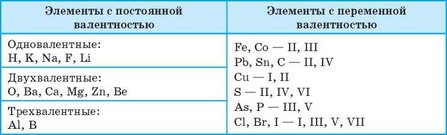
По известной валентности одного химического элемента можно определить валентность других элементов в соединении. Определим, например, валентность элементов в молекуле хлороводорода HCl. Атомы Гидрогена всегда одновалентны, следовательно, валентность атомов Хлора также равна единице, поскольку атом Хлора связан только с атомом Гидрогена и не может образовать с ним более одной связи. В молекуле аммиака NH3 атом Нитрогена связан с тремя
одновалентными атомами Гидрогена, следовательно, Нитроген трехвалентен, так как он образует три связи. Исходя из этого, можно изобразить графические формулы хлороводорода и аммониака:

В химических формулах валентность записывают над символом соответствующего элемента:
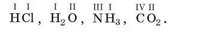
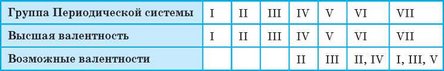
Валентность химических элементов можно определить по Периодической системе. Высшая (максимальная) валентность химического элемента в большинстве случаев равна номеру группы Периодической системы, в которой расположен данный элемент. Чтобы определить и другие возможные валентности, необходимо из значения высшей валентности вычесть 2, 4 или 6 (табл. 4).
Таблица 4. Определение валентности по Периодической системе*
* Для короткого варианта Периодической системы.
Приведенный в таблице 4 принцип определения валентности с помощью Периодической системы не всегда точен. Из него есть исключения. Например, Оксиген (шестая группа) проявляет только валентность II, а для Феррума (восьмая группа) характерны валентности II и III. Однако для большинства элементов, с которыми вы будете сталкиваться в школьном курсе, этот принцип справедлив.
Определение валентности химических элементов по формулам бинарных соединений
Соединения, состоящие из двух химических элементов, называют бинарными. Для определения валентности элементов в бинарном
соединении не обязательно составлять структурные формулы. Суммарное число связей атомов одного элемента в бинарном соединении всегда равно суммарному числу связей всех атомов другого элемента. Например, в молекуле углекислого газа С02 Карбон четырехвалентен (общее число связей равно 1 • IV = 4), а Оксиген двухвалентен (общее число связей равно 2 • II = 4). Для всех элементов в бинарном соединении произведение числа атомов на валентность будет одинаковым.
Для определения валентности в бинарных соединениях можно использовать следующий алгоритм:
|
Порядок действий |
Примеры вычислений |
||
|
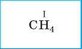
1. Указываем валентность элемента с известной (постоянной) валентностью |
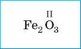 |
 |
 |
|
2. Умножаем число атомов данного элемента на его валентность |
 |
 |
 |
|
3. Делим полученное значение на число атомов другого элемента |
 |
 |
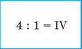 |
|
4. Записываем значение валентности над символом данного элемента |
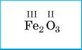 |
 |
 |
Составление формулы бинарного соединения по валентности элементов
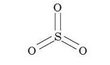
Зная значения валентностей элементов, можно составить формулу бинарного соединения. Составим, например, формулу соединения, которое состоит из атомов шестивалентного Сульфура — 8^1) и двухвалентного Оксигена — 0(11). Каждый атом Оксигена образует только две связи, поэтому для образования шести связей с атомом Сульфура понадобится три атома Оксигена. Таким образом, формула этого соединения — 803, а его графическая формула:
Составляя химические формулы, необходимо учитывать порядок написания символов элементов в формуле. На первом месте в химической формуле записывается символ того элемента, который в Периодической системе расположен левее или ниже. Так, если соединение состоит из атомов Нитрогена и Оксигена, то на первом месте записывается символ Нитрогена, а если соединение состоит из атомов Калия и Брома, то на первом месте — символ Калия.
Для составления формул бинарных соединений также можно воспользоваться следующим алгоритмом:
|
Порядок действий |
Примеры вычислений |
||
|
1. Записываем символы элементов в нужном порядке и обозначаем их валентность |
 |
 |
 |
|
2. Находим наименьшее общее кратное (НОК) для значений валентностей элементов |
 |
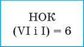 |
 |
|
3. Число атомов данного элемента равно отношению НОК к валентности этого элемента |
 |
 |
 |
|
4. Записываем полученные индексы после символов элементов |
 |
 |
 |
Понятие валентности возникло более двухсот лет назад и сегодня вызывает множество нареканий от многих химиков. Так, по приведенным правилам сложно определить валентность элементов в простых веществах, а также в веществах немолекулярного строения. Например, в железе каждый атом Феррума окружен восемью соседними атомами. В поваренной соли — натрий хлориде — каждый ион Натрия взаимодействует с шестью ионами Хлора, а каждый ион Хлора — с шестью ионами Натрия (рис. 606, с. 71). Вместе с тем Натрий и Хлор в этом соединении принято считать одновалентными. Понятие валентности имеет реальный смысл только в случае молекулярных веществ.
; Лингвистическая задача
Во многих европейских языках слово «валентность» имеет множество однокоренных слов. Так, в испанском языке valencia означает «цена». Французское слово valable и английское valid означают «способность» (соответственно, invalable и invalid — «неспособный»). Также есть слова value — «значение» и valeur — «стоимость». У древних римлян слово valentia означало «сила». Как вы считаете, что ! означает слово «валентность»?
Выводы:
1. Валентность равна числу связей, которые определенный атом может образовать с другими атомами. При составлении графических формул связи обозначают черточками.
2. Некоторые элементы проявляют постоянную валентность во всех соединениях: Гидроген всегда одновалентен, Оксиген — двухвалентен и т. д. Некоторые элементы проявляют переменную валентность, валентность таких элементов обязательно указывают в названиях соединений.
3. Для определения валентности по химической формуле или при составлении формул по валентности необходимо придерживаться принципа, что общее число связей всех атомов одного элемента в соединении равно общему числу связей всех атомов другого элемента.
Контрольные вопросы
1. Дайте определение валентности.
2. Какие элементы проявляют постоянную валентность, а какие — переменную?
3. Рассмотрите алгоритм определения валентности элементов в бинарных соединениях на примере углекислого газа С02.
4. Рассмотрите алгоритм составления формул бинарных соединений по валентности элементов на примере сульфур(У1) флуорида.
Задания для усвоения материала
1. Укажите ряд, в котором приведены символы элементов, способных проявлять валентность II: а) Fe, СІ, Р, S; б) Н, F, К, №; в) Мд, Ва, Са, О.
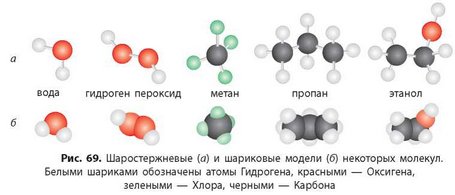
2. Модели молекул можно представлять по-разному: шаростержневые модели (рис. 69а) и шариковые (рис. 696). Рассмотрите модели молекул, определите валентности всех химических элементов и составьте химические формулы приведенных соединений.
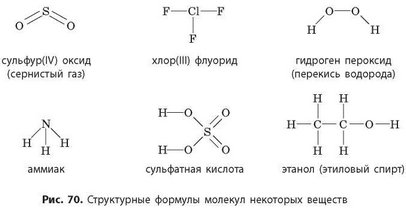
3. Определите валентность всех элементов по графическим формулам, изображенным на рисунке 70. Составьте химические формулы приведенных соединений.
4. Определите валентности элементов в следующих соединениях: а) P2O5; б) H2S; в) SnCl4; г) PH3; д) Mn2O7; е) Na2O.
5. С помощью Периодической системы определите все возможные валентности, которые могут проявлять элементы: а) Кальций; б) Суль-фур; в) Бром; г) Фосфор; д) Аргентум; е) Бор. У элементов с переменной валентностью обозначьте высшую и низшую валентности.
6. Составьте формулы соединений, образованных элементами: а) H и Al(III); б) C(IV) и S(II); в) Pb(IV) и O; г) Br(I) и Zn(II); д) C(IV) и F(I); е) O и Fe(II); ж) Cl(IV) и O; з) Cu(I) и O; и) Cl(I) и Au(III). В скобках указана валентность, которую проявляет элемент в данном соединении.
7. По рисунку 60а на с. 71, определите валентности атомов Силиция и Оксигена в кварце.
8. Составьте графические формулы соединений со следующими формулами: а) SO3; б) SO2; в) NO; г) H2S.
9. Феррум в соединениях с Оксигеном может проявлять валентность II и III. Составьте формулы этих соединений и определите, в какой из них содержание Феррума больше (по массовой доле).
Первые высказывания о химической связи принадлежат Роберту Бойлю. Он представлял атомы в виде шариков, на поверхности которых есть крючки. Этими крючками атомы цепляются друг за друга, как колючие головки репейника. Наличием и числом крючков на поверхности атомов Бойль также объяснял кислый, горький или жгучий вкус некоторых веществ.
Это материал учебника Химия 7 класс Григорович
Автор: admin от 19-01-2017, 03:23, Переглядів: 4813