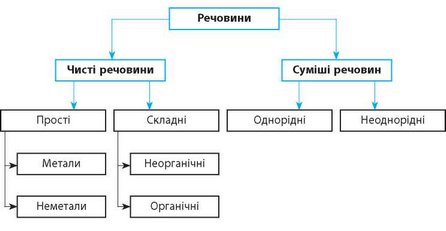
Прості та складні речовини
Пригадайте: суміші складаються з молекул різних речовин; у суміші речовини зберігають свої хімічні та фізичні властивості; суміші можна розділити на чисті речовини певними методами.
Прості речовини
У природі існує величезна різноманітність речовин, і всі вони відрізняються за складом і будовою. Речовини можуть складатися як з однакових, так і з різних атомів. Відповідно, всі чисті речовини за складом поділяють на прості та складні.
Речовина, утворена одним хімічним елементом, є простою.
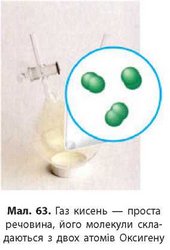
Наприклад, речовина залізо складається тільки з атомів Феруму, його формула Fe (мал. 59, с. 71). Газ кисень складається з молекул, утворених тільки атомами Оксигену (мал. 63), його формула O2. Часто назва простої речовини відрізняється від назви хімічного елемента, який її утворює, проте нерідко назви простих речовин і хімічних елементів збігаються. За правилами сучасної української хімічної номенклатури назви елементів пишуться з великої літери, а назви речовин — із маленької. Наприклад: «речовина алюміній складається з атомів Алюмінію», «речовина бром складається з молекул, утворених двома атомами Брому».
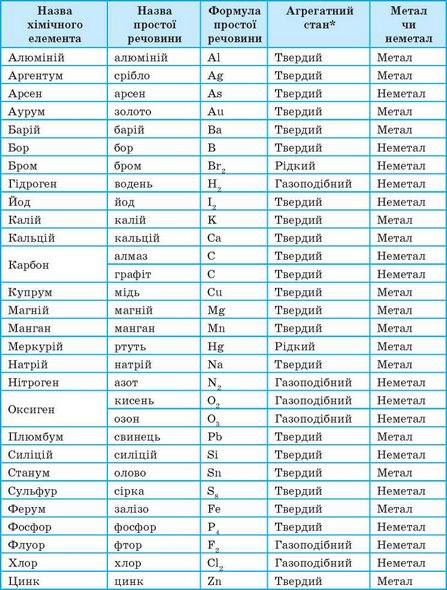
У таблиці 2 (с. 82) наведені назви простих речовин, які утворені відомими вам хімічними елементами.
Необхідно розрізняти поняття «проста речовина» і «хімічний елемент». Речовини й елементи характеризуються різними властивостями. Для речовин характерні агрегатний стан, колір, густина тощо.
А властивості хімічних елементів — це властивості їхніх атомів: будова (розміри), здатність віддавати або приєднувати електрони тощо.
* За звичайних умов.
Коли ми говоримо про матеріал або компонент суміші — наприклад, банка наповнена газуватим хлором, приготуємо розчин брому, візьмемо невеликий шматочок фосфору, — то в даному випадку йдеться про просту речовину. Якщо ж ми говоримо, що заряд ядра атома Хлору дорівнює +17, речовина містить Фосфор, молекула складається з двох атомів Брому, то маємо на увазі хімічний елемент.
• Багато хімічних елементів можуть утворювати не одну, а декілька простих речовин. Це явище називають алотропія, а прості речовини, утворені цим хімічним елементом,— алотропними модифікаціями. Алотропні модифікації відрізняються одна від одної за будовою або складом молекул. Наприклад, атоми Карбону утворюють декілька простих речовин: алмаз, графіт, карбін, фулерен. Вони відрізняються за розташуванням атомів один щодо одного. Атоми Оксигену утворюють дві алотропні модифікації: кисень ф2) і озон ф3). Ці дві речовини відрізняються за складом молекул. Алотропні модифікації — це різні прості речовини зі своїми власними фізичними та хімічними властивостями.
Метали та неметали
Метали — залізо, хром, цинк, магній, золото, свинець та інші — відрізняються від неметалів характерним металічним блиском і ковкістю, вони добре проводять електричний струм і теплоту (мал. 64). За звичайних умов усі метали (за винятком ртуті) перебувають у твер-

дому агрегатному стані. Властивості металів зумовлені їхньою внутрішньою структурою. Метали є речовинами атомної будови.
Неметали, на відміну від металів, не мають металічного блиску (за винятком йоду та графіту) (мал. 65). Вони крихкі й руйнуються від удару, погано проводять електричний струм і теплоту. Неметали можуть бути твердими, рідкими і газуватими (див. табл. 2, с. 82).
Чіткої межі між металами та неметалами не існує. Наприклад, йод і графіт є неметалами, але обидва мають металічний блиск, а графіт слабко проводить електричний струм. Для зарахування речовин до металів або неметалів слід брати до уваги всі їхні фізичні властивості в сукупності, а також їхню внутрішню будову та хімічні властивості.
Як і прості речовини, хімічні елементи поділяють на металічні й неметалічні. Метали утворені металічними елементами, а неметали — неметалічними.
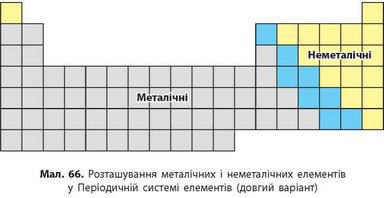
Якщо провести умовну лінію від Бору до Астату, то в довгому варіанті Періодичної системи над лінією розташовані неметалічні елементи, а під нею — металічні (мал. 66, див. також останній форзац). У короткому варіанті Періодичної системи під цією лінією також розташовані металічні елементи, а над нею — як металічні, так і неметалічні елементи (див. перший форзац). Отже, визначати, є елемент металічним чи неметалічним, зручніше за довгим варіантом Періодичної системи. Цей поділ умовний, оскільки всі елементи так чи інакше виявляють як металічні, так і неметалічні властивості, але в більшості випадків такий розподіл відповідає дійсності.

Класифікація елементів на металічні та неметалічні ґрунтується на здатності атомів віддавати або приймати електрони в хімічних реакціях. Атоми металічних елементів переважно віддають електрони і перетворюються на позитивно заряджені йони. Атоми неметалічних елементів переважно приймають електрони та перетворюються на негативно заряджені йони.
складні речовини
Речовина, яку утворюють декілька хімічних елементів, є складною.
Складні речовини також називають хімічними сполуками. До них належать кухонна сіль, сода, глюкоза, вода, оцтова кислота та багато інших. Складних речовин у природі існує значно більше, ніж простих.
Складні речовини можуть бути утворені різним числом елементів:
• двома (метан СН4, кварц вЮ2, вуглекислий газ С02);
• трьома (сода №2С03, мармур СаС03, сульфатна кислота Н2804);
• чотирма (малахіт (Си0Н)2С03);
• п’ятьма (сіль Мора (МН4)^е(в04)2).
Відомі речовини, у складі яких міститься понад десять хімічних елементів.
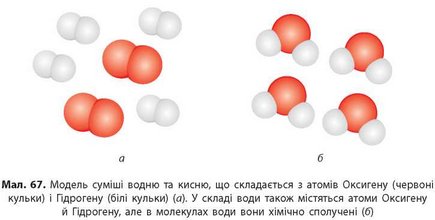
Складні речовини слід відрізняти від сумішей простих речовин (мал. 67, с. 86), які також складаються з атомів різних елементів. Для цього необхідно пригадати відмінні риси сумішей і чистих речовин (див. § 5). Кількісне співвідношення компонентів суміші може
бути різним, а хімічні сполуки мають сталий склад. Наприклад, можна приготувати суміш 100 г води з однією ложкою цукру, а можна і з двома або півтори ложками. А в сполуці FeS на кожний атом Феруму припадає лише один атом Сульфуру, а не півтора або три.
Тобто склад сполук можна описати однією хімічною формулою, а склад сумішей — ні.
Окрім того, компоненти суміші зберігають свої фізичні та хімічні властивості. Наприклад, якщо змішати залізний порошок із сіркою, то утвориться суміш двох речовин. І сірка, і залізо в її складі зберігають свої властивості: залізо притягується магнітом, а сірка не тоне у воді. Із цієї суміші за допомогою магніту можна відокремити залізо. Якщо ж залізо і сірка прореагують один з одним, утвориться нова сполука з формулою FeS. Ця сполука вже не виявляє властивостей ані заліза, ані сірки, вона має свої властивості. Ніяким методом розділення сумішей ми не зможемо виділити атоми Феруму зі сполуки FeS.
Класифікація складних речовин
Складні речовини поділяють на дві великі групи: неорганічні та органічні. Неорганічні речовини можуть складатися з атомів будь-яких елементів. У складі органічних сполук обов’язково містяться атоми Карбону, тому більшість з них при нагріванні обвуглюються. Переважна більшість органічних речовин містить також атоми Гідрогену. Прикладами органічних речовин є: метан СН4, сахароза
Іранський учений-енциклопедист, лікар, алхімік і філософ. Здобув різнобічну освіту — вивчав медицину, філософію, метафізику, поезію, магію та алхімію. Прославився як майстерний лікар. саме він сформулював основне завдання алхімії як перетворення металів за допомогою «еліксиру», а також добування із звичайних каменів (кварцу та скла) коштовних. Ар-Разі першим запропонував класифікацію всіх відомих речовин на землисті (мінеральні), рослинні і тваринні. Мінеральні речовини він розподіляв на шість груп: «духи», або спирти (ртуть, нашатир, сірка тощо); «тіла», тобто метали (золото, срібло тощо); «камені» (ляпіс, малахіт, бірюза, гіпс тощо); купороси; «бораки» та солі.

етиловий спирт C2H5OH, оцтова кислота СH3COOH. Органічних речовин існує значно більше, ніж неорганічних.
Неорганічні й органічні речовини, у свою чергу, поділяються ще на низку груп. Але в сьомому класі ви детальніше ознайомитеся лише з неорганічними речовинами, а інші вивчатимете в подальшому курсі хімії.
Розподіл речовин на різні групи за їхніми ознаками і властивостями називається класифікацією. У цьому параграфі ми розглянули основну класифікацію речовин, яку можна зобразити такою схемою:
ЛАБОРАТОРНИЙ ДОСЛІД № 2
Ознайомлення зі зразками простих і складних речовин
Обладнання: штатив із пробірками, пробіркотримач, нагрівальний прилад.
Реактиви: мідний купорос, залізо, цинк, алюміній, мідь, сірка, цукор, крейда, графіт, питна сода, кухонна сіль.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі.
1. Уважно розгляньте видані вам зразки речовин.
2. Для кожного зразка відзначте наявність металічного блиску, забарвлення, твердість.
3. Зважаючи на формули речовин, розподіліть їх на прості і складні. Із-поміж простих речовин визначте метали та неметали.
4. На підставі яких ознак можна відрізнити метали?
5. Чи можна за якими-небудь ознаками відрізнити прості речовини від складних?
6. Свої спостереження запишіть у зошиті і зробіть висновки.
Висновки:
1. Прості речовини складаються з одного хімічного елемента. Прості речовини розділяють на метали і неметали. Для металів характерні металічний блиск, ковкість, електро- та теплопровідність. Метали утворені переважно металічними елементами, а неметали — неметалічними.
2. Складні речовини складаються з декількох хімічних елементів, їх також називають хімічними сполуками. Складні речовини розділяють на органічні та неорганічні. У складі неорганічних можуть міститися будь-які хімічні елементи, а в органічних сполуках обов'язково є атоми Карбону і Гідрогену.
Контрольні запитання
1. Дайте визначення простим і складним речовинам.
2. На які групи речовин поділяють прості і складні речовини? За якими фізичними властивостями вони відрізняються?
3. Які елементи утворюють метали, а які — неметали?
4. Наведіть приклади простих речовин молекулярної і атомної будови.
5. У чому полягає різниця між поняттями: а) «хімічний елемент» і «проста речовина»; б) «проста речовина» і «складна речовина»; в) «складна речовина» і «суміш речовин»?
6. Які речовини належать до органічних, а які — до неорганічних? Наведіть приклади.
Завдання для засвоєння матеріалу
1. Виберіть фізичні властивості, характерні для алюмінію: а) твердий; б) газуватий; в) блискучий; г) крихкий; д) пластичний; е) добре проводить електричний струм; є) не проводить електричного струму; ж) швидко нагрівається.
2. Із наведеного переліку випишіть назви неметалічних елементів: Гідроген, Аурум, Йод, Плюмбум, Аргентум, сульфур, Меркурій.
3. Випишіть окремо формули простих і складних речовин: Fe2O3, Mg, ^, NaHCO3, Au, 02, №, Cu(OH)2, He, ^, №0, S8. Підкресліть символи, які позначають прості речовини — метали.
4. Наведіть по п'ять прикладів металічних і неметалічних елементів.
5. Обчисліть масову частку Натрію в кухонній солі (№0) і харчовій соді (№НТО3). У якій із цих складних речовин уміст Натрію більший?
6. Як можна довести, що целюлоза (основна речовина, з якої складається деревина) та сахароза є органічними речовинами?
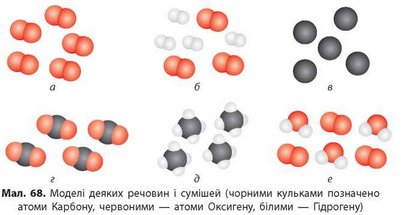
7. На малюнку 68 зображені моделі простих і складних речовин, а також їх сумішей. Для кожного випадку a) — є) визначте, моделі яких речовин (простих чи складних) зображені, запишіть хімічні формули цих речовин. Визначте, у якому випадку зображена суміш речовин, складіть хімічні формули речовин у суміші.
8. Малахіт (речовина зеленого кольору) під час нагрівання розкладається на купрум(ІІ) оксид CuO (порошок чорного кольору), воду H2O і вуглекислий газ ТО.,. Чи є малахіт сумішшю купрум(ІІ) оксиду, води та вуглекислого газу? З яких хімічних елементів складається малахіт?
9. Речовина хлор СІ2 є дуже отруйним газом, але водночас атоми Хлору містяться у складі кухонної солі №СІ, яку ми вживаємо щодня. Чи немає в цьому суперечності? Відповідь поясніть.
10*. У природі трапляється 89 хімічних елементів, проте простих речовин налічується близько 600. Як можна пояснити цей факт? Наведіть належні приклади. Чим можна пояснити існування значно більшої кількості складних речовин порівняно з кількістю простих речовин?
• Існування алотропних модифікацій Стануму пояснює так звану «олов'яну чуму». Звичайне біле олово на лютому морозі перетворюється на іншу алотропну модифікацію — дуже крихке сіре олово. Через це олов'яні вироби на морозі розсипаються на порошок.
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:37, Переглядів: 36896