Валентність
Поняття про валентність
При утворенні молекул атоми з’єднуються не безладно, а в певній послідовності особливими хімічними зв’язками. Кожний атом може утворити не нескінченне, а тільки певне число таких зв’язків. У XIX столітті вчені встановили, що атоми різних елементів мають різну здатність приєднувати до себе інші атоми. Так, наприклад, було помічено, що атом Гідрогену може приєднати тільки один атом іншого хімічного елемента (HCl, HF, NaH), атом Оксигену — два атоми Гідрогену (H2O), атом Нітрогену — три атоми Гідрогену (NH3).
Ця властивість атомів була названа валентністю.
Валентність — це число зв'язків, які певний атом може утворити з іншими атомами.
Щоб показати, як атоми сполучені в молекулі, використовують графічні (структурні) формули. Вони показують не тільки число атомів у молекулі, але й послідовність їх сполучення.
Графічна формула молекули води Н20 записується так:
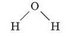
Із цієї формули видно, що в молекулі атом Оксигену сполучений з двома атомами Гідрогену, причому атоми Гідрогену один з одним не зв’язані. Кожний хімічний зв’язок у графічній формулі позначається рискою. Атом Оксигену утворює два зв’язки, отже, валентність Оксигену дорівнює двом (Оксиген двовалентний), а атоми Гідрогену утворюють по одному зв’язку — валентність Гідрогену дорівнює одиниці (Гідроген одновалентний).
Розглянемо молекулу вуглекислого газу С02. Графічна формула має такий вигляд:
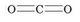
У молекулі вуглекислого газу атоми Оксигену утворюють по два зв’язки з атомом Карбону (такий зв’язок називають подвійним), а Карбон у цьому випадку утворює чотири зв’язки (або два подвійні зв’язки). У цій сполуці валентність Карбону дорівнює чотирьом.
Деякі елементи виявляють сталу валентність — у всіх сполуках їм властиве тільки одне певне значення валентності. Так, Гідроген завжди одновалентний, а Оксиген завжди двовалентний. Інші елементи можуть виявляти різні валентності в різних сполуках. Наприклад, Сульфур може бути двовалентним, чотиривалентним і шестивалентним. Про такі елементи кажуть, що вони виявляють змінну валентність. Для позначення валентності використовують римські цифри.

За відомою валентністю одного хімічного елемента можна встановити валентність інших елементів у сполуці. Визначимо, наприклад, валентність елементів у молекулі хлороводню HCl. Атоми Гідрогену завжди одновалентні, отже, валентність атомів Хлору також дорівнює одиниці, оскільки атом Хлору зв’язаний тільки з атомом Гідрогену і не може утворити з ним більше одного зв’язку. У молекулі амоніаку NH3 атом Нітрогену зв’язаний з трьома одновалентними
атомами Гідрогену, отже, Нітроген тривалентний, оскільки утворює три зв’язки. Зважаючи на це, можна зобразити графічні формули хлороводню й амоніаку:
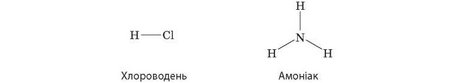
У хімічних формулах валентність записують над символом відповідного елемента:
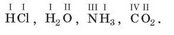
Валентність хімічних елементів можна визначити за Періодичною системою. Вища (максимальна) валентність хімічного елемента в більшості випадків дорівнює номеру групи Періодичної системи, у якій розташований цей елемент. Щоб визначити й інші можливі валентності, треба від значення вищої валентності відняти 2, 4 або 6 (табл. 4).
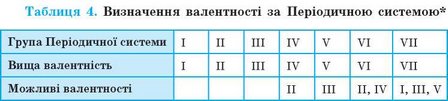
* Для короткого варіанта Періодичної системи.
Наведений у таблиці 4 принцип визначення валентності за допомогою Періодичної системи не завжди точний. Є винятки з нього. Наприклад, Оксиген (шоста група) виявляє тільки валентність II, а для Феруму (восьма група) характерні валентності II і III. Проте для більшості елементів, із якими ви матимете справу в шкільному курсі, цей принцип справедливий.
Визначення валентності хімічних елементів за формулами бінарних сполук
Сполуки, що складаються з двох хімічних елементів, називають бінарними. Для визначення валентності елементів у бінарній сполуці не обов’язково складати структурні формули. Сумарне число зв’язків атомів одного елемента в бінарній сполуці завжди дорівнює сумарному числу зв’язків усіх атомів іншого елемента.
Наприклад, у молекулі вуглекислого газу С02 Карбон чотиривалентний (загальне число зв’язків дорівнює 1 • IV = 4), а Оксиген двовалентний (загальне число зв’язків дорівнює 2 • II = 4). Для всіх елементів у бінарній сполуці добуток числа атомів на валентність буде однаковим.
Для визначення валентності в бінарних сполуках можна використати такий алгоритм:
|
Порядок дій |
Приклади обчислень |
||
|
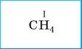
1. Указуємо валентність елемента з відомою (сталою) валентністю |
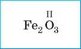 |
 |
 |
|
2. Множимо число атомів цього елемента на його валентність |
 |
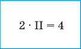 |
 |
|
3. Ділимо отримане значення на число атомів іншого елемента |
 |
 |
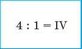 |
|
4. Записуємо значення валентності над символом цього елемента |
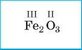 |
 |
 |
складання формули бінарної сполуки за валентністю елементів
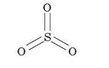
Знаючи значення валентностей елементів, можна скласти формулу бінарної сполуки. Складемо, наприклад, формулу сполуки, що складається з атомів шестивалентного Сульфуру — Б^І) і двовалентного Оксигену — О(ІІ). Кожний атом Оксигену утворює тільки два зв’язки, тому для утворення шести зв’язків з атомом Сульфуру необхідно три атоми Оксигену. Отже, формула цієї сполуки — 803, а її графічна формула:
Складаючи хімічні формули, необхідно враховувати порядок написання символів елементів у формулі. На першому місці в хімічній формулі записується символ того елемента, який у Періодичній системі розташований лівіше або нижче. Так, якщо сполука складається з атомів Нітрогену й Оксигену, то на першому місці записується символ Нітрогену, а якщо сполука складається з атомів Калію та Брому, то на першому місці — символ Калію.
Для складання формул бінарних сполук також можна скористатися таким алгоритмом:
|
Порядок дій |
Приклади обчислень |
||
|
1. Записуємо символи елементів у необхідному порядку та позначаємо їхню валентність |
 |
 |
 |
|
2. Знаходимо найменше спільне кратне (НСК) для значень валентностей елементів |
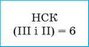 |
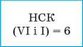 |
 |
|
3. Число атомів певного елемента дорівнює відношенню НСК до валентності цього елемента |
 |
 |
 |
|
4. Записуємо отримані індекси після символів елементів |
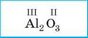 |
 |
 |
Поняття валентності виникло понад двісті років тому і нині викликає багато нарікань від багатьох хіміків. Так, за наведеними правилами складно визначити валентність елементів у простих речовинах, а також у речовинах немолекулярної будови. Наприклад, у залізі кожний атом Феруму оточений вісьмома сусідніми атомами. У кухонній солі — натрій хлориді — кожний йон Натрію взаємодіє із шістьма йонами Хлору, а кожний йон Хлору — із шістьма йонами Натрію (мал. 606, с. 71). Водночас Натрій і Хлор у цій сполуці прийнято вважати одновалентними. Поняття валентності має реальний сенс лише в тому разі, якщо йдеться про молекулярні речовини.
; Лінгвістична задача
У багатьох європейських мовах слово «валентність» має багато спільнокорене-вих слів. так, в іспанській мові Valencia означає «ціна». Французьке слово valable і англійське valid означають «здатність» (відповідно, invalable та invalid — «нездатний»). також є слова value — «значення» і valeur — «вартість». У стародавніх римлян слово valentia означало «сила». Як ви вважаєте, що означає слово «валентність»?
Висновки:
1. Валентність дорівнює числу зв'язків, які певний атом може утворити з іншими атомами. При складанні графічних формул зв'язки позначають рисками, отже, валентність дорівнює числу рисок у графічній формулі.
2. Деякі елементи виявляють сталу валентність в усіх сполуках: Гідроген завжди одновалентний, Оксиген — двовалентний тощо. Деякі елементи виявляють змінну валентність, валентність таких елементів обов'язково вказують у назвах сполук.
3. Для визначення валентності за хімічною формулою або при складанні формул за валентністю необхідно дотримуватися принципу, що загальне число зв'язків усіх атомів одного елемента в сполуці дорівнює загальному числу зв'язків усіх атомів іншого елемента.
Контрольні запитання
1. Дайте визначення валентності.
2. Які елементи виявляють сталу валентність, а які — змінну?
3. Наведіть алгоритм визначення валентності в бінарних сполуках. Розгляньте його на прикладі вуглекислого газу ТО.,.
4. Наведіть алгоритм складання формул бінарних сполук за валентністю елементів. Розгляньте його на прикладі сульфур(УІ) флуориду.
Завдання для засвоєння матеріалу
1. Укажіть ряд, у якому наведені символи елементів, здатних виявляти валентність ІІ: а) Яв, СІ, Р, Б; б) Н, Я, К, №; в) Мд, Ва, Са, О.
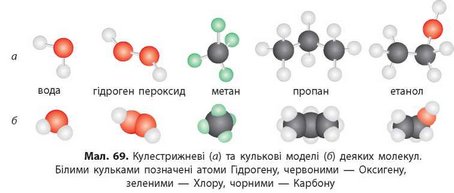
2. Моделі молекул можна представляти по-різному: кулестрижневі моделі (мал. 69а) та кулькові (мал. 696). Розгляньте моделі молекул, визначте валентності всіх хімічних елементів і складіть хімічні формули наведених сполук.
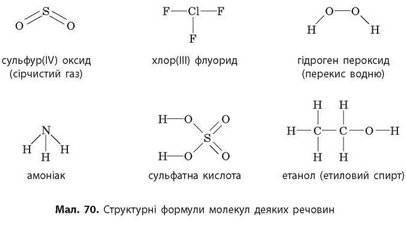
3. Визначте валентність усіх елементів за графічними формулами, зображеними на малюнку 70. складіть хімічні формули наведених сполук.
4. Визначте валентності елементів у таких сполуках: а) P2O5; б) H2S; в) SnCl4; г) PH3; д) Mn2O7; е) Na2O.
5. За допомогою Періодичної системи визначте всі можливі валентності, які можуть виявляти елементи: а) Кальцій; б) сульфур; в) Бром; г) Фосфор; д) Аргентум; е) Бор. В елементів зі змінною валентністю позначте вищу й нижчу валентності.
6. складіть формули сполук, утворених елементами: а) H і Al(III); б) C(IV) і S(II); в) Pb(IV) і O; г) Br(I) і Zn(II); д) C(IV) і F(I); е) O і Fe(II); є) Cl(IV) і O; ж) Cu(I) і O; з) Cl(I) і Au(III). У дужках вказано валентність, яку виявляє елемент у даній сполуці.
7. За малюнком 60а, с. 71, визначте валентність атомів силіцію й Оксиге-ну у кварці.
8. складіть графічні формули сполук із такими формулами: а) SO3; б) SO2; в) NO; г) H2S.
9. Ферум у сполуках з Оксигеном може виявляти валентність II і III. складіть формули цих сполук і визначте, у якій з них уміст Феруму більший (за масовою часткою).
Перші висловлювання про хімічний зв'язок належать Роберту Бойлю. Він уявляв атоми у вигляді кульок, на поверхні яких є гачки. Цими гачками атоми чіпляються один за одного, як колючі головки реп'яха. Наявністю і числом гачків на поверхні атомів Бойль також пояснював кислий, гіркий або пекучий смак деяких речовин.
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:38, Переглядів: 6552