Масова частка елемента в речовині
Хімічна формула речовини містить певну інформацію про речовину. Вона не тільки відображає якісний склад речовини (тобто інформацію про хімічні елементи, з яких вона складається), але й її кількісний склад.
Наприклад, у молекулі води на два атоми Гідрогену припадає один атом Оксигену. Сумарна відносна атомна маса атомів Гідрогену дорівнює 2 (2 • АДН) = 2 •І = 2), а відносна атомна маса атома Оксигену дорівнює 16 (АДО) = 16). Отже, на 2 масові частини Гідрогену у воді припадає 16 масових частин Оксигену.
Щоб описати кількісний склад речовин, використовують масову частку елемента у сполуці, яку можна обчислити за хімічною формулою. Масова частка елемента показує, яка частина маси речовини припадає на атоми даного елемента. Її обчислюють як відношення атомної маси даного елемента з урахуванням числа його атомів у молекулі до відносної молекулярної маси речовини:

Фізичний зміст масової частки полягає в тому, що вона показує масу атомів даного елемента в 100 г речовини. Масова частка може виражатися в частках одиниці або відсотках. Щоб перевести частки одиниці у відсотки, слід одержані за формулою значення помножити на 100 %. Сума масових часток усіх елементів, що містяться у складі сполуки, має дорівнювати 1 або 100 %.
Приклад 1. Обчисліть масові частки хімічних елементів у вуглекислому газі ^2.
Розв’язання:
Обчислимо відносну молекулярну масу вуглекислого газу:
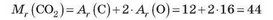
Обчислимо масові частки Карбону й Оксигену:
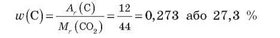
Зверніть увагу на те, що сума масових часток Карбону й Оксигену дорівнює 1. Масову частку Оксигену можна також визначити, віднімаючи від одиниці масову частку Карбону:
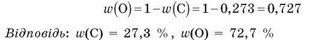
Приклад 2. Обчисліть масу атомів Оксигену, що містяться у воді масою 1 кг.
Розв’язання:
Обчислимо масову частку Оксигену у воді:
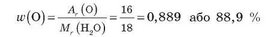
Масова частка елемента показує частину маси речовини, що припадає на цей елемент. Обчислимо масу атомів Оксигену у воді масою 1 кг:
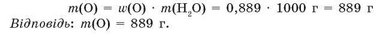
Закони Пруста і Дальтона
До початку XIX століття вимірюванням мас речовин не надавали особливого значення і в науці існувала думка, що склад речовини може змінюватися залежно від способу 'її добування.
Видатний французький хімік, син аптекаря. Із 11 років вивчав аптекарське мистецтво. У лабораторії свого батька на самоті дуже любив змішувати реактиви, у результаті чого мало не отруївся отруйним газом. Із 14 років вивчав хімію в Парижі. Був керівником кафедри хімії в університеті Мадрида.

Пруст проводив дослідження в різних галузях хімії — мінералогії, фармації, аналітичній хімії, вивчав порохові суміші. Він винайшов ліки від цинги та деякі харчові добавки, розробив технологію виділення цукру з винограду та буряку. Відкрив закон сталості складу речовин.
І справді, чому сполука завжди має містити, скажімо, 4 г елемента Х і 1 г елемента Y? Чому вона не може містити 4,1 або 3,9 г Х? Але якщо матерія складається з атомів, то сполука утворюється в результаті з’єднання одного атома Х з одним атомом Y в одну молекулу, і ніяк інакше. У цьому випадку співвідношення мас атомів Х і Y мають бути сталими й не залежати ні від чого.
Виконавши численні досліди, французький хімік Ж. Л. Пруст довів сталість співвідношення мас елементів у різних речовинах. На підставі своїх експериментів він сформулював закон сталості складу речовини, який стверджує, що будь-яка речовина має сталий склад незалежно від способу її добування. Наприклад, кисень можна добути розкладанням різних речовин, але його формула завжди буде однакова — О2.
Пізніше Дж. Дальтон визначив, що атоми різних елементів можуть сполучатися в різних співвідношеннях, але ці співвідношення завжди кратні відносним атомним масам елементів. Наприклад, атоми Карбону й Оксигену можуть утворювати молекули СО (чадний газ) і СО2 (вуглекислий газ). Але у цьому випадку утворюються різні речовини, для кожної з яких характерна сталість складу. Ці дослідження Дальтона згодом оформилися в закон кратних співвідношень.
Висновки:
1. Хімічна формула містить інформацію про кількісний склад речовини. За хімічною формулою можна визначити співвідношення мас атомів різних хімічних елементів у речовині.
2. За хімічною формулою обчислюють масову частку елемента в речовині як відношення маси атомів певного елемента до відносної молекулярної маси речовини. Масова частка елемента показує, яка частина маси речовини припадає на певний хімічний елемент.
Контрольні запитання
1. У який спосіб можна визначити кількісний склад речовин?
2. Як обчислюється масова частка елемента в речовині? Наведіть формулу для її обчислення.
3. Який фізичний зміст має масова частка елемента в речовині?
4. Виберіть правильні твердження: а) за хімічною формулою можна дізнатися, які хімічні елементи містяться у складі речовини; б) за хімічною формулою можна дізнатися співвідношення атомів різних елементів у речовині; в) за хімічною формулою можна дізнатися, скільки атомів кожного елемента міститься у складі молекули речовини; г) за хімічною формулою можна дізнатися форму молекули речовини.
5. Виберіть правильну відповідь. Масова частка елемента в речовині показує: а) у скільки разів маса одного атома більша за масу молекули; б) масу атомів даного хімічного елемента в 100 г речовини; в) відношення маси атомів даного хімічного елемента до молекулярної маси; г) скільки атомів кожного елемента міститься у складі молекули.
Завдання для засвоєння матеріалу
1. Обчисліть масові частки всіх елементів у сполуках із такими хімічними формулами: а) І\Ю2; б) РЬСІ2; в) І\Іа2С03; г) И2Б04; д) Ва3(Р04)2.
2. Формула глюкози С6Н1206, формула сахарози С12Н22011. У якій речовині масова частка Оксигену більша?
3. Обчисліть масу атомів Гідрогену, що містяться в амоніаку І\ІН3 масою 10 г.
4. Маса води на Землі оцінюється такою, що приблизно дорівнює 1,45 ■ 1018 тонн. Обчисліть, яка маса атомів Гідрогену й Оксигену міститься в цій масі води.
За співвідношенням мас атомів у XIX столітті були визначені хімічні формули майже всіх відомих на той час речовин. Можливість вираження складу речовини простими співвідношеннями стала одним із доказів існування атомів.
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:37, Переглядів: 10498