Періодична система хімічних елементів Д. І. Менделєєва
Періодична система — перелік відомих елементів
Ми вже згадували про Періодичну систему хімічних елементів, а зараз ознайомимося з нею детальніше. Періодичну систему можна подати як своєрідний перелік хімічних елементів. Проте це не просто перелік. Періодична система відображає класифікацію хімічних елементів, що ґрунтується на особливостях будови їхніх атомів. У ній існує безліч закономірностей і залежностей, з якими ви ознайомитеся під час вивчення хімії.
Видатний російський учений. Народився в родині директора тобольської гімназії. Закінчив Петербурзький педагогічний інститут, де згодом викладав хімію. Його роботи присвячені не лише хімії, але й фізиці, технології, економіці та географії. Найбільше його досягнення — відкриття періодичного закону. створив у Росії першу палату мір і ваг. У 1887 році сам здійснив політ на повітряній кулі для спостереження сонячної корони під час затемнення, пролетів 100 км на висоті близько 4 км. Висував свою кандидатуру на здобуття Нобелівської премії, але так і не отримав її: Нобелівську премію запровадили лише в 1901 році і давали тільки за відкриття, здійснені в рік присудження.


Періодична система була складена на основі періодичного закону, відкритого в 1869 році Д. І. Менделєєвим. Періодичний закон ми розглянемо трохи пізніше, а до Періодичної системи звертатимемося впродовж усього курсу вивчення хімії. На момент створення Періодична система містила лише 63 елементи — саме стільки їх було відкрито на той час (мал. 56). У міру відкриття нових елементів вона доповнювалася новими даними. На честь Д. І. Менделєєва хіміки називають Періодичну систему його ім’ям. Геніальність Д. І. Менделєєва полягала в тому, що він передбачив існування невідкритих на той час елементів і залишив для них вільні місця в таблиці.
Сьогодні до Періодичної системи внесено 118 елементів. Вона поповнюється щойно відкритими елементами, і поки що вчені не можуть однозначно стверджувати, скільки всього елементів може існувати.
Структура Періодичної системи
Періодична система хімічних елементів має вигляд таблиці. Елементи в ній розташовані в певному порядку — у міру збільшення маси їхніх атомів. Кожний елемент має свій порядковий номер, і цей номер дорівнює заряду ядра атомів цього елемента.
Існує багато різновидів зображення Періодичної системи: кругові, спіральні, пірамідальні, із розташуванням елементів зверху вниз і зліва направо. Найбільш загальноприйнятим є зображення у вигляді таблиці з розташуванням елементів зліва направо.
У Періодичній системі всі елементи об’єднані в періоди — горизонтальні ряди елементів, і групи — вертикальні ряди елементів. У довгому варіанті Періодичної системи елементи об’єднані в 7 періодів і 18 груп, а в короткому — також у 7 періодів, але у 8 груп (див. форзаци).
У нашій країні традиційно користуються короткоперіодним варіантом. Міжнародне товариство ГОРАС2 рекомендує для використання довгоперіодний варіант Періодичної системи.
Перші три періоди називають малими, оскільки в них міститься невелике число елементів: у першому періоді містяться тільки 2 елементи (Гідроген і Гелій), а в другому і третьому — по 8 елементів. Решту періодів називають великими: у четвертому і п’ятому періодах містяться по 18 елементів, а у шостому і сьомому — по 32 елементи.
Групи об’єднують елементи з подібними властивостями. Деякі групи елементів мають назви, наприклад, група лужних елементів або група інертних елементів.
У нижній частині таблиці розташовані родини елементів — лантаноїди та актиноїди. Ці елементи розміщені після Лантану (№ 57) й Актинію (№ 89) і формально належать до третьої групи. Проте розміщення цих елементів у таблиці зробило б її громіздкою і незручною, тому їх зазвичай виносять за її межі.
Кожний елемент має свою «адресу» в Періодичній системі. Щоб описати місце елемента в Періодичній системі, треба назвати його порядковий номер, а також номер групи та періоду. Наприклад: елемент Оксиген має порядковий номер 8, розміщений у другому періоді, шостій групі.
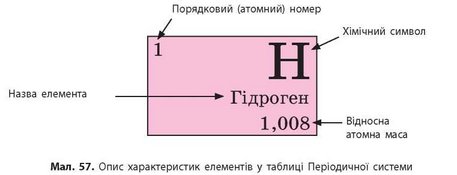
Елементи, так само як речовини або молекули, мають певні властивості. Найважливіші характеристики елементів, наведені в Періодичній системі, — це порядковий номер, відносна атомна маса тощо (мал. 57).
Висновки:
1. Періодична система містить усі відомі на сьогодні хімічні елементи. Вона складається із семи періодів — горизонтальних рядів, та восьми груп (короткий варіант) — вертикальних рядів.
2. Перші три періоди називають малими, вони складаються з 2 або 8 елементів, а інші — великими, вони складаються з 18 елементів і більше. Деякі групи елементів також мають власні назви.
Контрольні запитання
1. Зі скількох періодів і груп складається сучасна Періодична система?
2. Що називають періодом і групою Періодичної системи?
3. Які періоди Періодичної системи називають малими, а які — великими?
4. Наведіть приклади групових назв хімічних елементів.
5. скільки елементів міститься в перших трьох періодах Періодичної системи? Виберіть правильну відповідь: а) 10; б) 18; в) 24; г) 63.
Завдання для засвоєння матеріалу
1. Запишіть символи та назви елементів другого періоду Періодичної системи.
2. скільки елементів міститься: а) у третьому періоді; б) п'ятому періоді?
3. Запишіть символи наведених елементів і опишіть їхнє місце в Періодичній системі: Гідроген, Карбон, Фосфор, Ферум, Аргентум.
4. Як за допомогою Періодичної системи визначити заряд ядра атома? Визначте заряд ядер в атомів Карбону, Нітрогену, Хлору та Кальцію.
5. Укажіть у Періодичній системі елемент із зарядом ядра +79. Запишіть його символ, назву. У якому періоді (великому чи малому) він розташований? скільки електронів міститься в атомі цього елемента?
6*. Знайдіть у додатковій літературі приклади елементів, які добуті вченими штучно і не існують у природі. Укажіть їхні порядкові номери та назви.
7*. Чому, на вашу думку, з усіх відкритих хімічних елементів у природі трапляється тільки 89? Як учені відкрили інші елементи?
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:33, Переглядів: 3505