Генетична інженерія і методи молекулярної генетики
Формальною датою народження генної інженерії можна вважати 1972 р., коли Берг (Paul Berg) і співробітники отримали першу реком-бінантну ДНК, яка складалася з ДНК вірусу SV40 і бактеріофага L Удосконалення технології рекомбінантних ДНК і пов'язаних із нею методів відіграло велику роль у розвитку молекулярної генетики та молекулярної біології в цілому: структура й функції практично будь-якого гена та продуктів його експресії стали доступні для дослідження, з'явилась можливість детального вивчення величезних геномів вищих організмів і систем їхньої регуляції. Сучасні підходи для здійснення різноманітних маніпуляцій із молекулами ДНК є сьогодні не тільки головним інструментарієм для фундаментальних досліджень у галузі молекулярної генетики, а й основою для розвитку нових біотехнологій, котрі базуються на генетичній модифікації мікроорганізмів, рослин і тварин як продуцентів продуктів харчування та біологічно активних сполук.
Методи генної інженерії
Основні ферменти генної інженерії
Головним інструментом для здійснення генно-інженерних операцій є природні ферменти, які каталізують реакції деградації та синтезу нуклеїнових кислот. Особливе місце серед них належить рестриктним ендонуклеазам (рестриктазам), що здійснюють специфічне розрізання молекули ДНК усередині певних елементів послідовності нуклеотидів. Рестриктази (існує кілька сотень таких ферментів) виконують у бактеріальних клітинах роль захисту від чужорідної ДНК бактеріофагів. Назви цих ферментів утворюються за таким принципом: перша велика літера позначає рід мікроорганізму, дві маленькі - вид, римські цифри та іноді великі літери - порядковий номер рестриктази серед інших рестриктаз даної бактерії. Наприклад, EcoRI - рестриктаза RI із Escherichia coli.
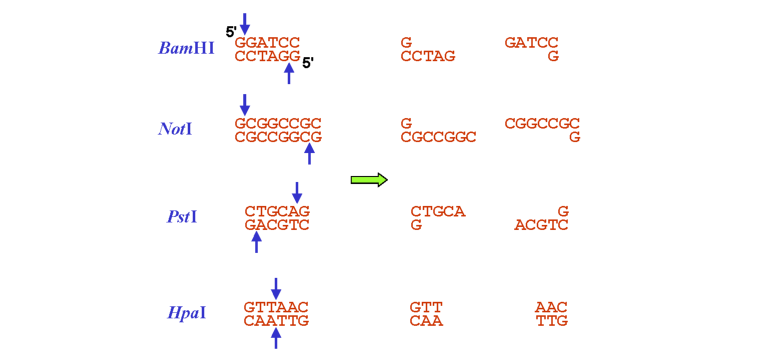
Послідовності нуклеотидів, які впізнаються рестриктазами, відрізняються великою різноманітністю: сайтом рестрикції є невеликі (4, 6, іноді трохи більше пар основ) паліндромні послідовності (такі, що читаються однаково в напрямку 5'-3' по обох ланцюгах, рис. 9.1). Залежно від типу рестриктази, два розрізи, які вона здійснює, можуть бути розташованими точно один напроти одного у двох ланцюгах, що зумовлює утворення так званих тупих кінців. Частіше рестриктази залишають взаємно комплементарні 5'-кінцеві (іноді 3'-кінцеві) одно-ланцюгові вирости - липкі кінці (рис. 9.1).
 |
|
Рис. 9.1. Приклади рестриктних сайтів (ліворуч, стрілками позначено місця розрізів) та продуктів рестрикції (праворуч). Рестриктази BamHI та NotI залишають липкі кінці з 5'-кінцевими виступами, PstI - із 3'-кінцевими виступами, HpaI - тупі кінці |
Крім того, часто використовують різноманітні менш специфічні нуклеази - ферменти, що каталізують реакцію гідролізу нуклеїнових кислот. Нуклеази можуть діяти тільки на молекули ДНК (ДНКази) або РНК (РНКази); вибірково гідролізувати тільки одноланцюгову (нуклеа-за S1) або дволанцюгову (екзонуклеаза ІІІ) молекулу ДНК; діяти тільки на гібридну молекулу РНК-ДНК (РНКаза Н) тощо.
Наступний важливий для генної інженерії фермент - ДНК-залежна ДНК-полімераза (див. розділ 1). Найчастіше використовують ДНК-полі-меразу І E. coli. Їй притаманні три види каталітичної активності:
• полімеразна, що зумовлює синтез ланцюга ДНК у напрямку 5'-3' на одноланцюговій ДНК-матриці у присутності чотирьох нуклеозидтрифосфатів і короткого ДНК-праймера, який має вільну 3'-гідроксильну групу;
• 3'-екзонуклеазна, яка спричиняє відщеплення нуклеотидів від 3'-кінця з метою редагування помилок;
• 5'-екзонуклеазна, що забезпечує відщеплення нуклеотидів від 5'-кінця полінуклеотидного ланцюга.
За рахунок першої та третьої активностей ДНК-полімераза І одночасно може каталізувати реакцію полімеризації та гідроліз нуклеотидного ланцюга в напрямку 5'-3', починаючи з одноланцюгового розриву у дво-ланцюговій ДНК. Такий процес називається нік-трансляцією: при цьому розрив (нік) переміщується вздовж ланцюга ДНК у напрямку 5'-3' на відстань до однієї тисячі пар нуклеотидів. Нік-трансляцію використовують, зокрема, для введення в ДНК радіоактивно мічених нуклеотидів.
Від ДНК-полімерази І за допомогою трипсину або субтилізину можна відокремити великий фрагмент (фрагмент Кленова), що зберігає тільки полімеразну та 3'-екзонуклеазну активності. Відсутність 5'-екзо-нуклеазної активності дає змогу, зокрема, використовувати фрагмент Кленова для "заповнення" одноланцюгових 5'-кінцевих виступів, що утворюються при розрізанні ДНК рестриктазами.
Також використовують ДНК-полімеразу фага Т4. Їй притаманні ті самі активності, що й фрагменту Кленова, але її 3'-екзонуклеазна активність є у 200 разів вищою. Відповідно, цю полімеразу застосовують для введення мітки до рестриктів із виступами 3'-кінців.
ДНК-лігаза являє собою ще один із найважливіших інструментів генної інженерії. Вона каталізує синтез фосфодіефірного зв'язку між 5'-фосфатним і 3'-гідроксильними кінцями в місці одноланцюгового розрізу (ніка) у дволанцюговій молекулі ДНК. Найчастіше використовують ДНК-лігазу фага Т4, яка здатна в присутності АТР зшивати фрагменти ДНК із липкими кінцями: два взаємно комплементарні липкі кінці утворюють подвійну спіраль з двома ніками (рис. 9.1), які зашиваються лігазою.
Для синтезу ДНК на РНК-матриці використовують РНК-залежну ДНК-полім&разу - зворотну транскриптазу. Назва ферменту пов'язана з тим, що він каталізує реакцію, зворотну першому етапу експресії гена - транскрипції, первинним продуктом реакції є гібрид
РНК-ДНК. У генній інженерії зазвичай використовують зворотну транскриптазу з РНК-вірусів птахів (див. розділ 5). Вона складається з двох субодиниць і має щонайменше дві активності: ДНК-поліме-разну (може використовувати як матрицю одноланцюгові РНК або ДНК); активність РНКази Н (гідролізує РНК у складі гібрида РНК-ДНК, але не атакує вільну РНК). Таким чином, фермент синтезує на РНК-матриці комлементарну молекулу ДНК (кДНК).
Серед інших різноманітних ферментів, які використовують у генній інженерії, слід згадати термінальну дезоксинуклеотидилтранс-феразу, яка може нарощувати нуклеотиди на 3'-кінець одноланцюго-вої молекули ДНК. З її допомогою можна "підтупити" кінці ДНК (якщо 3'-кінець є коротшим) або подовжити одноланцюгові 3'-кінцеві вирости (безматричний синтез ДНК - використовуються нуклеотиди, що наявні в реакційній суміші).
Клонування ДНК
Методами клонування будь-які фрагменти ДНК, отримані за допомогою рестриктаз, можна вбудувати в плазміду або ДНК бактеріофага - вектор для молекулярного клонування, а потім розмножити ці генетичні елементи в клітинах бактерій або дріжджів, збільшуючи їхню кількість у мільйони разів.
Необхідність використання вектора зумовлена тим, що при звичайному введенні ДНК у клітини вона піддається дії нуклеаз, які розщеплюють її до нуклеотидів. Щоб ДНК стала складовою частиною генетичного апарату клітини, вона повинна або вбудуватися в її геном, або бути здатною до автономної реплікації.
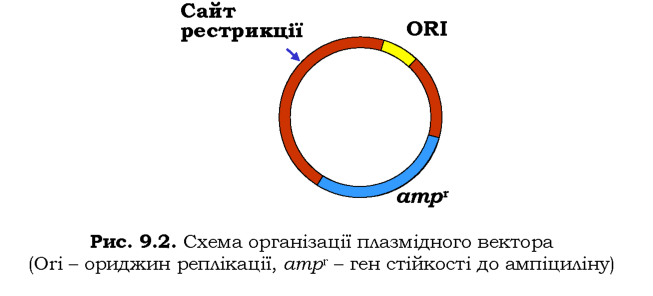
Як вектор для клонування часто використовують бактеріальні плазміди (розділ 5). Основними вимогами до плазміди як вектора є наявність у її складі ориджина реплікації, унікального (одного на плазміду) сайта, що впізнається певною рестриктазою, і гена стійкості до одного з антибіотиків як селективного маркера (рис. 9.2). Із метою створення рекомбінантної ДНК очищену плазміду, яка містить єдиний сайт певної рестриктази, обробляють цією рестриктазою та отримують лінійний вектор з липкими кінцями. Далі додають фрагмент ДНК, який було вилучено за допомогою тієї самої рестриктази. За рахунок комплементарної взаємодії між липкими кінцями фрагмента й вектора утворюється циркулярний нековалентний комплекс двох молекул ДНК. Завдяки використання ДНК-лігази полінуклеотидні ланцюги зшиваються - утворюється реком.бінантна молекула ДНК. Найзручнішими є плазмідні вектори, котрі містять так званий полілінкер - ділянку з певним набором унікальних рестриктних сайтів, що дозволяє підібрати одну з рестриктаз, найбільш придатну для кожного випадку.
Фрагменти ДНК із тупими кінцями також можна вбудувати у вектор за допомогою лігази, хоча така реакція є на порядок менш ефективною. За допомогою термінальної трансферази до З'-кінців фрагмента ДНК можна приєднати, наприклад, одноланцюговий poly(A)-хвіст, а до З'-кінців лінійного вектора - poly(T). При змішуванні між комплементарними одноланцюговими кінцями відбудеться спарювання, остаточне зшивання завершує ДНК-лігаза. Таким чином можна об'єднувати будь-які фрагменти з тупими кінцями, незалежно від методу їхнього отримання.
Ферментативним шляхом можна утворити тупі кінці на фрагментах із липкими кінцями. Для цього або здійснюють видалення одно-ланцюгових виростів за допомогою нуклеази S1, або липкі кінці забудовують за допомогою фрагмента Кленова. Утворений фрагмент із тупими кінцями вбудовують у вектор за вже описаним методом.
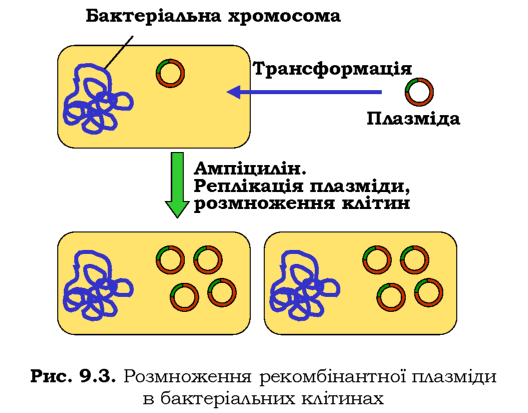
Трансформаця бактеріальних клітин рекомбінантною плазмідою здійснюється зазвичай у розчині CaCl2 або шляхом електропорації (через суспензію клітин проводиться короткий імпульс електричного струму). В обох випадках підвищується проникність клітинної стінки й рекомбінантна плазміда потрапляє всередину. Далеко не всі бактерії отримують плазміду при трансформації, і тут стає в пригоді ген стійкості до антибіотика: достатньо обробити бактеріальну культуру цим антибіотиком, щоб залишити тільки трансформовані клітини. Далі відбувається автономна реплікація плазміди й розмноження самих клітин, що приводить до значного зростання загальної кількості плазмід (рис. 9.З). Клоновані плазміди виділяють із бактеріальної культури, а обробка їх тією самою рестриктазою, що була використана при виготовленні рекомбінантної молекули, дозволяє вирізати з вектора клонований фрагмент ДНК.
Найпоширенішими плазмідними векторами сьогодні є штучні плазміди - похідні від плазміди pUC (pBluescript, pGEM). Це невеликі (~2,7 тис. пар основ) мультикопійні плазміди, що містять ген стійкості до антибіотику, ориджин і полілінкер, вбудований у ген lacZ. Полілін-кер сам по собі не впливає на експресію цього гена, продуктом якої є фермент, який перетворює певний синтетичний субстрат на сполуку синього кольору. Якщо фрагмент ДНК вбудовується в полілінкер, це порушує експресію гена lacZ, і можна легко відбирати тільки ті клони бактерій, котрі містять рекомбінантну ДНК.
Чим менша плазміда за розміром, тим вона стабільніша, а отже, і трансформація бактерій плазмідами є ефективнішою. Відповідно, існує обмеження в розмірі фрагментів, що їх можна клонувати описаним шляхом - до 10 тис. пар основ. Альтернативною, але цілком аналогічною технікою, що дозволяє працювати з фрагментами довжиною приблизно 20 тис. пар основ, є клонування ДНК із використання векторів на основі бактеріофага X (див. розділ 5). За допомогою рестриктази фрагмент ДНК вбудовується у фагову ДНК, додаються порожні фагові оболонки, і здійснюється збірка фагових частинок in vitro. Рекомбінантними бактеріофагами заражають бактеріальну культуру, де відбувається їхнє розмноження.
Використовуючи вектори на основі космід, можна клонувати фрагменти ДНК до 40 тис. пар основ. Косміда є плазмідою, яка крім ориджину, сайтів рестрикції та генів стійкості до антибіотиків містить два так звані cos-сайти: липкі кінці лінійної молекули ДНК бактеріофага X. Саме за рахунок cos-сайтів лінійна молекула фагової ДНК циркуляризується після її проникнення в бактеріальну клітину. У лінійну косміду з такими липкими кінцями вбудовується фрагмент ДНК, який бажано клонувати. Рекомбінантна косміда упаковується in vitro у фагові частинки, якими обробляють бактеріальну культуру. У цьому випадку бактеріофаг використовується як ефективний засіб трансформації: лінійна косміда проникає в клітину, де за рахунок cos-сайтів і бактеріальної лігази циркуляризується. Далі циркулярна косміда розмножується, як звичайна плаз-міда за схемою на рис. 9.3.
Для клонування фрагментів ДНК від 100 тис. пар основ розроблені спеціально сконструйовані вектори ВАС і YAC. BAC-вектори створено на основі F-плазмід бактерій (розділ 5). YAC-вектор являє собою штучну дріжджову мініхромосому, яка містить центромеру, теломери і точку початку реплікації. У такий вектор можна ввести чужорідний фрагмент ДНК розміром понад 100 тис. пар основ, і така мініхромо-сома, уведена в дріжджову клітину, буде реплікуватись і поводити себе аналогічно до інших дріжджових хромосом при мітотичному поділі.
Більшість сучасних векторних систем поліфункціональні, тобто придатні не тільки для клонування ДНК, а й для експресії рекомбі-нантних білків.
Геномні бібліотеки
Розглянуті принципи клонування фрагмента ДНК залишають питання, звідки береться той чи інший фрагмент ДНК. Для того, щоб працювати з певною ділянкою ДНК (наприклад, певним геном) спочатку здійснюють клонування великої кількості різноманітних фрагментів геному - створюють бібліотеку клонів, серед яких уже шукають потрібний.
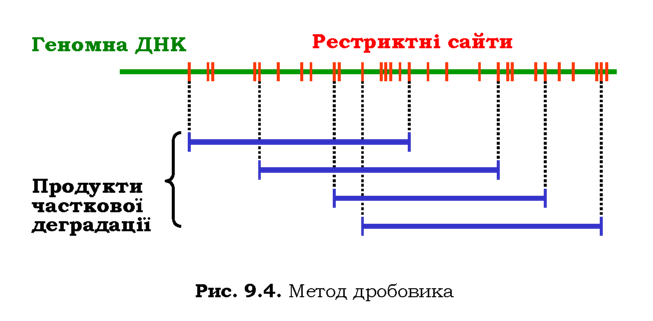
Стандартна процедура створення бібліотеки - метод дробовика (shotgun) - розпочинається з часткової (протягом обмеженого часу) обробки всієї геномної ДНК певною рестриктазою - так, щоб отримати набір різноманітних фрагментів, що перекриваються, певної середньої довжини (рис. 9.4). Усі такі фрагменти вбудовуються у вектори, після чого здійснюється трансформація. Бактерії висіваються на твер-де середовище таким чином, що кожна колонія веде походження від однієї клітини. Отже, набір колоній - це набір різноманітних клонів, кожен з яких містить один із фрагментів геному.
Аналогічно до геномних бібліотек створюють бібліотеки клонів кДНК. Для цього спочатку виділяють сумарну мРНК із клітин певного типу. Використовуючи зворотну транскриптазу та oligoT, що комплементарні до З'-кінцевих polyA-хвостів мРНК, як праймери, на цих мРНК синтезують комплементарні ланцюги ДНК. Далі отримані молекули кДНК піддають клонуванню. На відміну від геномної, бібліотека клонів кДНК містить тільки кодуючі послідовності (екзони) генів і тільки таких генів, які є активними в клітинах даного типу.
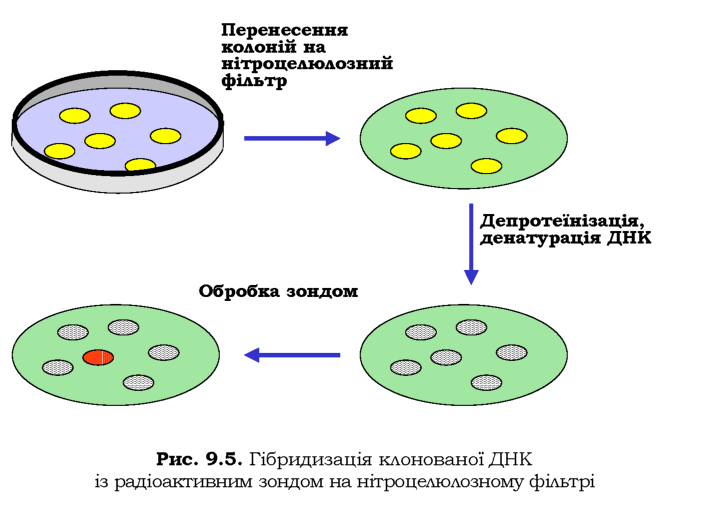
Потрібну нуклеотидну послідовність серед бібліотеки клонів можна знайти за допомогою гібридизації клонованої ДНК із радіоактивно міченим ДНК-зондом (рис. 9.5). Колонії бактерій у чашці Петрі переносять на нітроцелюлозний фільтр - роблять своєрідну репліку. Потім здійснюють лізис клітин, депротеїнізацію та денатурацію ДНК у лужному розчині. Після висушування фільтра одноланцюгову ДНК необер-нено фіксують на ньому. Фільтр обробляють радіоактивно міченою ДНК певної послідовності - зондом. Якщо зонд комплементарний ДНК клона, відбувається гібридизація - ренатурація дволанцюгової ДНК. Детектування цього факту за допомогою авторадіографії дозволяє ідентифікувати розшукуваний клон.
Синтез зонда найчастіше проводять, використовуючи базу даних EST (Expressed Sequence Tag). База є загально доступною колекцією великої кількості коротких (200-400 пар основ) фрагментів послідовностей кДНК багатьох організмів. Достатньо знайти в EST-базі коротку ділянку, що відповідає фрагменту послідовності білка (ген якого розшукується), і синтезувати її, щоб приготувати зонд.
Секвенування (див. нижче) кожного з фрагментів, які містяться в геномній бібліотеці клонів, і порівняння послідовностей фрагментів, що перекриваються (рис. 9.4), дозволяє розмістити клоновані фрагменти в порядку їхньої локалізації в геномі, тобто встановити повну послідовність геному.
Велика кількість послідовностей (у тому числі повних послідовностей геномів), які вже встановлені й продовжують накопичуватись, створює завдання їхнього збереження та аналізу. Зрозуміло, що таке завдання (яке постає вже при порівнянні послідовностей окремих клонованих фрагментів із метою з'ясувати нуклеотидну послідовність геному) може бути виконаним лише за допомогою комп'ютерів. Біоінформатика - галузь, пов'язана з вирішенням зазначених проблем, сьогодні є невід'ємною складовою частиною генетики. Найбільші загальнодоступні через інтернет бази даних нуклеотидних і амінокислотних послідовностей створено в Європейській Лабораторії Молекулярної Біології (EMBL Sequence Data Base) і Національних Інститутах Здоров'я США (GenBank). На відповідних порталах розміщено також програмні засоби порівняння послідовностей, пошуку промоторів, стартових точок транскрипції, інтронів і екзонів, визначення білкових послідовностей із послідовностей нуклеотидів тощо. На основі біоінформатичного аналізу можна встановити, наприклад, функціональне значення невідомого щойно клонованого гена по його гомології з відомим геном іншого організму, структуру гена (знайти промотор, екзони, точки термінації транскрипції), структурно-функціональні особливості нових білків, функціональні зв'язки між різними білками й генами, філогенетичні стосунки між різними таксонами. Завдяки розвитку біоінформатики з'явилась можливість, у доповнення до результатів, що отримують in vivo та in vitro, вирішувати різноманітні проблеми просто за допомогою комп'ютера - in silico.
Полімеразна ланцюгова реакція
Альтернативним і додатковим до клонування методом збільшення кількості бажаного фрагмента ДНК - ампліфікації - є полімеразна ланцюгова реакція (ПЛР, або PCR - Polymerase Chain Reaction). ПЛР -це реакція синтезу ДНК in vitro, яка повторюється багато разів: синтезовані ланцюги стають матрицями для синтезу в наступному циклі реакції. Для здійснення ПЛР треба знати принаймні короткі послідовності ДНК на кінцях того фрагмента, що має бути ампліфікований.
Реакційна суміш містить слідову кількість вихідної ДНК, надлишкові кількості двох синтетичних праймерів до кінців фрагмента, нуклеозид-трифосфати чотирьох типів і ДНК-полімеразу Taq термофільної бактерії Thermus aquaticus. Використання саме полімерази Taq викликано тим, що вона не втрачає своєї активності при нагріванні до високих температур. У кожному циклі реакції відбувається нагрівання суміші до 95 °С (денатурація ДНК) і охолодження до 60 °С. Після охолодження до такої все ще досить високої температури ланцюги ДНК не ренату-рують, але праймери (оскільки вони присутні в досить високих концентраціях) знаходять свої комплементарні ділянки, зв'язуються з ними, і полімераза Taq починає працювати, подовжуючи ці праймери.
Метод ПЛР має надзвичайно широке застосування. Ним послуговуються кожного разу, коли є необхідність детектувати й дослідити невелику кількість ДНК, у тому числі - у складі неочищеного біологічного матеріалу. ПЛР застосовують також у комбінації з клонуванням: ампліфікований ДНК-продукт можна клонувати й використати, наприклад, для експресії білка (див. нижче); ампліфікація за допомогою ПЛР стає в пригоді для збільшення невеликої кількості клонованої ДНК.
Аналіз структури й експресії генів і геномів
Клонований або ампліфікований фрагмент ДНК можна дослідити різними способами, але найбільш вичерпну інформацію дає встановлення нуклеотидної послідовності (sequence) фрагмента - секвенування.
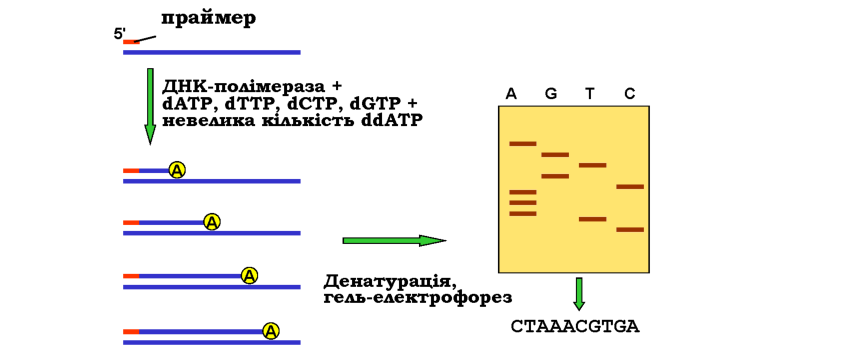
На рис. 9.6 показано схему найпопулярнішого сьогодні методу Сангера (Frederick Sanger). До одноланцюгової ДНК-матриці додається радіоактивно мічений праймер, повний набір дезоксинуклеозидтри-фосфатів (dNTP), ДНК-полімераза й невелика кількість дидезоксинук-леозидтрифосфату одного з чотирьох типів (наприклад, ddATP). Диде-зоксинуклеотид відрізняється тим, що містить атом Н замість ОН-групи не тільки при 2'-, а також і при 3'-атомі пентози (див. рис. 1.1). Відповідно, включення такого нуклеотиду в ланцюг, що синтезується, зупинить подальше зростання ланцюга внаслідок відсутності 3' ОН-групи на його кінці. Оскільки ddATP присутній у невеликій кількості, така подія буде відбуватися в різних точках ланцюга - в усіх, де стоїть аденін напроти тиміну в складі матриці. Денатурація продуктів реакції дасть набір мічених одноланцюгових фрагментів від праймера до кінцевого аденіну, довжина цих фрагментів у нуклеотидах дасть порядковий номер аденіну в складі ланцюга.
 |
|
Рис. 9.6. Секвенування ДНК за Сангером: схема синтезу ДНК у присутності дидезоксиАТР (ліворуч). Аналогічна процедура для інших трьох дидезоксинуклеотидів дає набір одноланцюгових фрагментів, що аналізуються за допомогою гель-електрофорезу в денатуруючих умовах (праворуч) - розподіл смуг дозволяє прочитати послідовність (праворуч внизу) 9К1 |
З метою визначення довжини фрагментів проводять гель-електро-форез одноланцюгової ДНК у денатуруючих умовах, на сусідні лунки геля наносять також продукти синтезу в присутності інших дидезок-синуклеотидів. Як показано на рис. 9.6, після електрофорезу та візуалі-зації смуг із такого геля можна прочитати нуклеотидну послідовність.
Інший сучасний підхід у секвенуванні (так зване піросеквенування), який реалізується на автоматизованих секвенаторах, дозволяє встановити послідовність значно швидше, дешевше й при цьому не потребує ані клонування ДНК, ані електрофорезу. Одноланцюгові фрагменти, отримані з невеликої кількості геномної ДНК, пришиваються своїми 5'-кінцями до мікрокульок (один фрагмент на кульку) і піддаються ампліфікації за допомогою ПЛР. Кожна кулька з пришитими до неї ампліфікованими ідентичними фрагментами розміщується в мікрореакторі, де здійснюється ДНК-полімеразна реакція. Нукле-озидтрифосфати подаються в реакційну суміш імпульсно один за одним. Якщо нуклеотид певного типу виявляється комплементарним матриці та включається у зростаючий ланцюг, пірофосфат, що при цьому звільняється, залучається до низки хімічних реакцій, де остання реакція супроводжується випромінюванням світла (хемілюмінесценція). Світловий сигнал фіксується оптичною системою, і послідовність таких сигналів читається як нуклеотидна послідовність. Реакція здійснюється паралельно у 200 тис. мікрореакторів (для 200 тис. фрагментів, які перекриваються), що дозволяє встановити послідовність приблизно 200 млн пар основ за 4,5 години.
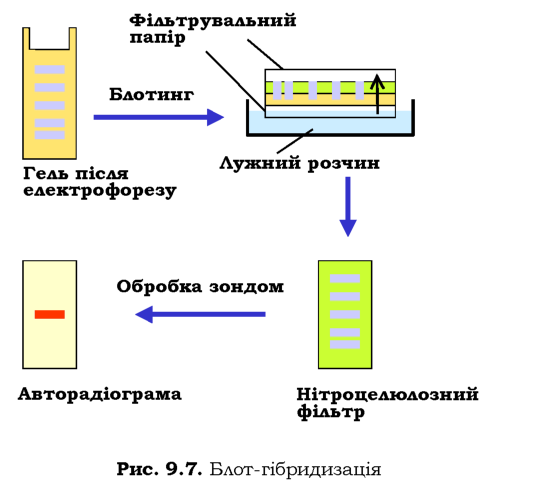
Зрозуміло, що далеко не завжди є потреба у визначенні послідовності ДНК, із якою має справу дослідник. Потужним засобом аналізу складних сумішей ДНК щодо наявності там специфічних елементів послідовності є блот-гібридизація на нітроцелюлозних фільтрах за Саузерном (Edward Southern). Назва процедури, яку схематично зображено на рис. 9.7, походить від слова blotting (промакування): фрагменти ДНК розділюються за допомогою гель-електрофорезу (залишаючись невидимими в гелі), після чого на гель накладають нітроцелюлозний фільтр, а під та над цим "сендвічем" розміщують фільтрувальний папір і занурюють нижній шар паперу в лужний розчин. Під дією капілярних сил розчин піднімається до верхнього шару паперу, "захоплюючи" при цьому ДНК і переносячи її з гелю на нітроцелюлозу. Одночасно при цьому ДНК денатурується лугом. У результаті одноланцю-гова ДНК опиняється на фільтрі - середовищі, придатному для подальшої гібридизації, а сам фільтр є точною реплікою вихідного гелю. Далі проводять обробку фільтра зондом - одноланцюговим фрагментом
ДНК певної послідовності, який містить радіоактивну мітку. Зонд гібридизується з комплементарною ДНК у певних досі невидимих смугах, що можна зафіксувати за допомогою авторадіографії.
У такий спосіб можна встановити, наприклад, присутність специфічних послідовностей ДНК у препаратах; наявність у геномі додаткових копій послідовності, що є гомологічними до вже відомої; присутність у невивченому геномі генів, гомологічних відомим генам тощо. Прикладом одного з численних застосувань Саузерн-блотингу є метод фингерпринтингу ДНК (DNA fingerprinting). Метод базується на факті наявності в еукаріотичних геномах мінісателітних повторів -невеликих елементів послідовності, які тандемно повторюються в різних місцях геному кілька разів. Розподіл локусів за кількістю повторів є індивідуальним - так само, як відбитки пальців. З метою ідентифікації особини (чи особи - у криміналістиці, судових справах тощо) геномну ДНК обробляють рестриктазою, котра не має своїх сайтів усередині повтору. Фрагменти розділюються шляхом електрофорезу, здійснюється блотинг і гібридизація з радіоактивно міченим елементом послідовності мінісателіта. У результаті на авторадіограмі представлено специфічний для особини набір фрагментів різної довжини, тобто різної кількості повторів мінісателіта - своєрідний молекулярний відбиток (DNA fingerprint).
Нозерн-блотинг відрізняється від описаної процедури блотингу за Саузерном (назва nothern є просто жартівливою аналогією з буквальним значенням прізвища Саузерна) лише тим, що на гель для електрофорезу наноситься сумарний препарат виділеної мРНК. Гібридизація з міченим фрагментом ДНК (наприклад, кДНК із бібліотеки клонів) дозволяє встановити наявність певної мРНК, тобто активність гена, у клітинах певного типу після дії активуючих / репресуючих факторів тощо, а також оцінити рівень цієї активності (концентрацію мРНК) за інтенсивністю забарвлення смуги на авторадіограмі.
Проаналізувати повну програму активності генів організму чи клітин певного типу за певних фізіологічних умов або у процесі розвитку, а також виконувати інші завдання, пов'язані з вивченням функціонування цілого геному, дозволяють методи, що базуються на використанні ДНК-мікроареїв (DNA-microarrays) або ДНК-чіпів (DNA-microchips).
Фрагмент ДНК довжиною до 1 тис. пар основ, для якого відомо його розташування в геномі, ампліфікується, і одноланцюгові продукти ампліфікації пришиваються до невеликої зони на поверхні предметного скла мікроскопа. Скло розміром 2 х 2 см - ДНК-мікроарей -покрито сіткою із приблизно 6 тис. таких мікроплям, кожна з яких містить ДНК певної геномної ділянки.
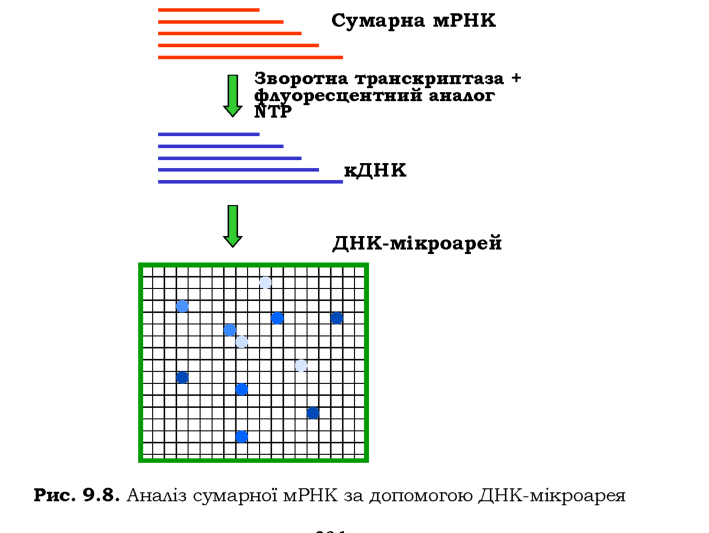
Одну з типових схем використання мікроарея зображено на рис. 9.8. Сумарна мРНК, отримана з клітин певного типу, використовується як матриця в реакції зворотної транскрипції. Поряд зі звичайними, до реакційної суміші додається флуоресцентний аналог одного з NTP. У результаті маємо препарат флуоресцентно міченої кДНК. Після гібридизації з цією кДНК мікроарей аналізують за допомогою флуоресцентного мікроскопа: наявність флуоресцентної плями свідчить про активність певного гена, інтенсивність флуоресценції - про рівень цієї активності.
Експерименти такого типу дозволяють з'ясувати зміни загальної програми експресії генів при змінах зовнішніх умов, активність різних генів у різних тканинах багатоклітинного організму, зміни активності груп генів у процесі диференціювання клітин.
Експресія рекомбінантних білків
Методи генної інженерії дозволяють не тільки здійснювати різноманітні операції з нуклеїновими кислотами, а й отримувати практично будь-які білки у великих кількостях. Ген, що кодує даний білок, можна клонувати, вбудувати (наприклад, у бактеріальну плазміду) і змусити бактеріальну культуру продукувати цей білок. Виділення та очищення білка з культури біохімічними методами не є принциповою проблемою, зважаючи на його велику кількість.
Одну з найпростіших схем експресії білка в E. coli зображено на рис. 9.9. Зрозуміло, що еукаріотичний ген не має сенсу вводити у прокаріотичну клітину - прокаріоти не мають системи сплайсингу. Тому беруть лише кодуючу частину гена, яку можна отримати з бібліотеки клонів кДНК. Використовуючи придатну рестриктазу та лігазу, потрібну кДНК вбудовують у плазмідний вектор для експресії поряд із промотором - наприклад, лактозного оперона (див. розділ 2). Здійснюють трансформацію рекомбінантної плазміди в бактеріальні клітини, до бактеріальної культури додають синтетичний індуктор lac-оперона IPTG. Промотор активується, після чого здійснюється транскрипція гена та трансляція білка.
Більш ефективна двоступенева система експресії використовує промотор РНК-полімерази бактеріофага Т7. У бактеріальному геномі ані таких полімераз, ані відповідних промоторів немає. У клітину вводяться два плазмідні вектори: один містить lac-промотор і ген РНК-полімерази Т7, інший - сильний промотор полімерази Т7 разом із геном білка, що має бути експресований. IPTG індукує експресію полі-мерази, яка зв'язується тільки з промотором у складі другої плазміди (інших промоторів немає) і забезпечує синтез великої кількості білка.
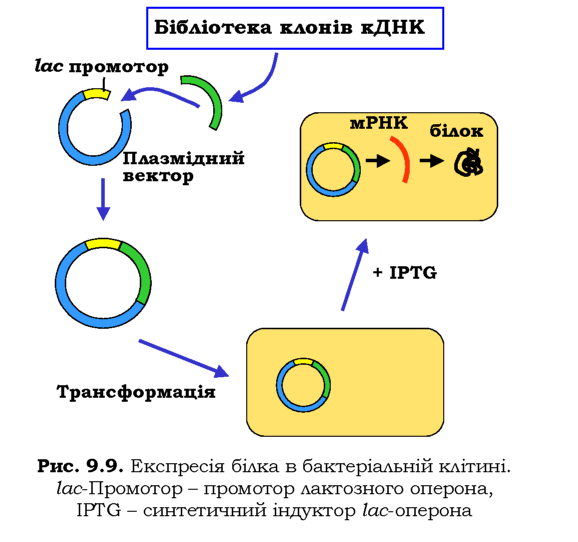
Велика кількість білків, у тому числі ферменти, що використовуються у рекомбінантних технологіях, виробляються сьогодні шляхом експресії в бактеріальних клітинах. Поряд із прокаріотичними розробляються та використовуються також системи експресії рекомбінантних білків в еукаріотичних клітинах. Особливо важливими еукаріотичні системи експресії є для еукаріотичних білків, що не можуть бути синтезовані бактеріальною клітиною в активній формі. Зокрема, це стосується білків, що піддаються суттєвим посттрансляційним модифікаціям - наприклад, глікопротеїдів. Найпростішим для використання еукаріотичним "біореактором" є дріжджі, маніпулювати якими так само легко й так само дешево, як і бактеріями. Як дріжджові експре-суючі вектори використовують плазміди або штучні хромосоми YAC.
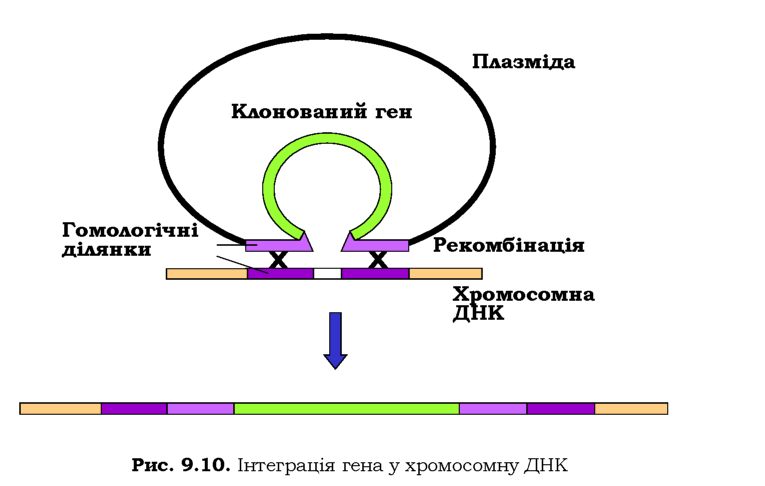
Крім того, часто буває доцільним вбудовування гена-мішені, що кодує бажаний білок, у хромосому клітини-хазяїна: клітина позбавляється при цьому зайвих витрат на реплікацію плазміди та синтез зайвих білків, гени яких несе плазміда. Здійснити інтеграцію можна за рахунок гомологічної рекомбінації між геномною ДНК і ділянками, що фланкують ген-мішень у плазміді (рис. 9.10).
Генетична інженерія мікробіологічних систем
Генетично модифіковані мікрооорганізми використовуються здебільшого як біореактори, що продукують білки для потреб медицини.
В основному це невеликі білки, що не піддаються посттрансляційним модифікаціям. Одним із перших промислових застосувань генетичної інженерії було отримання шляхом експресії у клітинах E. coli (за принциповою схемою рис. 9.9) гормону росту людини - соматотропіну. В організмі він секретується передньою часткою гіпофіза, а його дефіцит є причиною захворювання - гіпофізарної карликовості.
Отримання соматостатину являє собою цікавий приклад цілеспрямованого конструювання білків за допомогою методів генної інженерії. Це короткий пептид (містить 14 амінокислотних залишків), який синтезується у шлунково-кишковому тракті й гальмує вивільнення з гіпофізу гормону росту. Отримати соматостатин у клітинах бактерій у значних кількостях є складним завданням, оскільки він швидко руйнується протеолітичними ферментами. Щоб "обійти" внутрішньоклітинні бактеріальні протеази, було сконструйовано химерний білок-попередник. У його складі як N-кінцеву ділянку було використано білок бактерії, до якого приєднали сам соматостатин: звичайно, усе це було зроблено на рівні ДНК, зв'язувальним елементом у цій конструкції було використано триплет АТG, що кодує метіонін. Після виділення з клітин бактерій химерний білок обробляли бромціаном, унаслідок чого відбувалось його розщеплення за залишком метіоніну, і таким чином вилучався фізіологічно активний поліпептид. За аналогічною схемою було розроблено процес отримання інсуліну.
Шляхом експресії в E. coli отримують також інтерферони всіх трьох груп: а-, в- та у-інтерферони - антивірусні білки, які синтезуються імунокомпетентними клітинами. Проте недоліком використання бактеріальних клітин для отримання в- і у-інтерферонів (природні інтерферони цих двох груп - глікопротеїди) є відсутність у бактерій систем, що забезпечують посттрансляційні модифікації білків. Роль глікозилювання в- і у-інтерферонів не до кінця зрозуміла і, хоча неглі-козильовані форми цих білків практично повністю зберігають противірусну активність, це спонукає до розробки й використання систем експресії рекомбінантних інтерферонів в еукаріотичних клітинах.
Важливе місце в генетичній інженерії мікроорганізмів посідає виробництво рекомбінантних вакцин. Вони мають цілий ряд переваг перед традиційними вакцинами: характеризуються відсутністю (або значним зниженням вмісту) баластних компонентів, майже повною нешкідливістю та низькою вартістю. Можна назвати три основні підходи, які використовують для отримання таких вакцин:
• Модифікація мікроорганізму шляхом делеції генів, що відповідають за вірулентність. При цьому зберігається здатність викликати імунну відповідь, і мікроорганізм можна використовувати як живу вакцину.
• Перенесення антигенних детермінант патогенного мікроорганізму на непатогенний, який можна використовувати як вакцину.
• Клонування та експресія генів білків, котрі містять анигенні детермінанти. Білки використовують як вакцину, що провокує імунну відповідь.
Велике значення має використання мікроорганізмів для промислового виробництва органічних сполук. У такому виробництві, крім класичних технологій, усе ширше використовують технологію рекомбі-нантних ДНК, яка дозволяє спрямовано змінювати метаболізм мікроорганізмів, уводячи нові гени або модифікуючи такі, що вже існують. Прикладами є використання рекомбінантних мікроорганізмів для промислового синтезу L-аскорбінової кислоти (вітаміну С), барвника індиго, антибіотиків, цінних біополімерів тощо.
Мікроорганізми можуть приносити користь не тільки завдяки якомусь певному продукту, який ними синтезується, а й своєю дією на довкілля. Зокрема, бактерії можна використовувати для деградації ксенобіотиків (неприродних синтетичних хімічних речовин - гербіцидів, пестицидів, холодоагентів, хімічних відходів). Головну групу ґрунтових мікроорганізмів, що руйнують ксенобіотики, становлять бактерії роду Pseudomonas. Різні штами Pseudomonas здатні розщеплювати понад 100 органічних сполук, але кожен окремий штам використовує як джерело вуглецю тільки певну групу споріднених сполук і не використовує інших. Шляхом перенесення плазмід, які кодують ферменти різних катаболічних шляхів, в один реципієнт-ний штам було створено "супербацилу", що має надзвичайні ката-болічні властивості - вона здатна руйнувати більшість вуглеводнів нафти. Тепер генетично модифіковані штами природних ґрунтових мікроорганізмів використовуються для комплексної біологічного очищення стічних вод.
Генетична інженерія рослин
Одна з переваг рослинних клітин - їхня тотипотентність: з однієї клітини можна регенерувати цілу рослину. Отже, із клітин, сконструйованих генно-інженерними методами, можна отримати рослини, усі клітини яких несуть чужорідний ген чи гени. Часто такі трансгенні рослини, створені de novo, розмножують вегетативно. Генетична модифікація рослин може здійснюватись за допомогою спеціальних векторів або шляхом прямого перенесення генів.
Поширеним методом уведення генів у рослинні геноми є використання ґрунтової бактерії Agrobacterium tumefaciens. Агробактерії мають здатність інтегрувати свій генетичний матеріал у клітини дводольних рослин. Вони містять великі (близько 200 тис. пар основ) Ті-плазміди (tumor inducing), які несуть так звану Т-ДНК - ділянку, здатну інтегруватися в ядерний геном рослинної клітини. До складу Т-ДНК входять гени фітогормонів, продукти експресії яких індукують у трансформованих рослин утворення пухлин - корончастих галів. Гени, що відповідають за перенесення та інтеграцію Т-ДНК у геном рослин (vir-гени), знаходяться в іншій ділянці Ті-плазміди. Трансгенні рослини отримують, використовуючи модифіковану Т-ДНК, в якій онкогени замінені на будь-який ген, котрий бажано інтегрувати в рослинний геном. Таку неонкогенну плазміду конструюють генно-інженерними методами, клонують в E. coli, а потім вектор уводять в Л. tumefaciens: vir-гени забезпечують перенесення та інтеграцію бажаної ділянки. За допомогою агробактерій трансформовано велику кількість видів дводольних рослин, однак модифікація однодольних рослин (головні зернові культури - рис, пшениця та кукурудза) таким шляхом ускладнена.
Безвекторні системи дають можливість прямого перенесення чужорідної ДНК у будь-які рослинні клітини або протопласти (клітини, в яких відсутня клітинна стінка). При безвекторному перенесенні використовують методи електропорації, мікроін'єкції та біолістичний метод. Мікроін'єкцію проводять під мікроскопом за допомогою скляної голки, уводячи через неї ДНК у ядро клітини. Бомбардування клітин (біолістика) - інший дуже ефективний метод уведення ДНК у рослинну клітину. При цьому золоті або вольфрамові сферичні кульки діаметром 0,4-1,2 мкм покривають шаром ДНК, яку осаджують CaCl2, спермідином або поліетиленгліколем, і "вистрілюють" кульками в суспензію клітин зі спеціальної "рушниці". Кульки пробивають клітинну стінку, за рахунок чого ДНК потрапляє всередину клітини та з пев-ною імовірністю інтегрується в рослинну ДНК за допомогою не зовсім зрозумілого механізму. Пряме введення ДНК у протопласти рослин можна здійснити й за допомогою ліпосом - сферичних частинок, мембрани яких містять фосфоліпіди. Частинки обволікають трансфор-муючу ДНК і тим самим захищають її від нуклеаз. За допомогою ліпосом у протопласти рослин вдається ввести ДНК Ті-плазмід, а також цілі хромосоми.
Для ідентифікації трансформованих клітин і оцінки рівня експресії чужорідних генів на ранніх стадіях отримання трансгенних рослин використовують репортерні гени, продукти яких легко дете-ктуються за допомогою простих методів. Одним із таких генів є ген GUS, що кодує фермент p-D-глюкуронідазу, яка перетворює певний субстрат на сполуку, забарвлену в яскраво-блакитний колір. Інший ген - GFP - кодує флуоресцентний білок, котрий легко детектувати. Як правило, експресія репортерного гена корелює з рівнем експресії функціонального гена в трансгенній рослині. З метою мінімізувати вторгнення а рослинний геном останнім часом розробляються підходи з отримання безмаркерних трансгенних рослин. Наприклад, трансформують рослину двома різними ДНК, одна з яких несе маркерний ген, а інша - трансген, що має бути інтегрованим. У цьому випадку від 30 до 80 % рослин містить обидва гени, які, однак, інтегровані в різні ділянки геному рослини. Після відбору трансформан-тів маркерний ген можна видалити з трансгенної рослини за допомогою звичайного схрещування.
З метою забезпечити високий рівень експресії в рослинному геномі чужорідний ген оснащують сильним конститутивним промотором. Часто використовують, наприклад, так званий 35S-промотор - промотор РНК 35S вірусу мозаїки кольорової капусти, який забезпечує експресію в будь-яких геномах рослин. Велике значення мають також тканиноспецифічні промотори рослинних генів. Їхня перевага полягає в тому, що гени, які перебувають під їхнім контролем, експресу-ються тільки в певних тканинах. Так, будь-який ген, контрольований пататиновим промотором, буде експресуватись тільки в бульбах картоплі (пататин - запасний білок бульб картоплі, і тільки тут експресу-ються його гени). Подібні промотори використовують, коли необхідна експресія гена в певних органах рослин, наприклад - у коренях для захисту від ґрунтових патогенів.
Поліпшення харчових якостей рослин є однією з основних цілей їхньої генетичної модифікації. Так, до складу білків ендосперму зернових культур генно-інженерними методами вводять додаткові амінокислоти, що дозволяє отримувати якісніше зерно. Існують розробки, спрямовані на поліпшення складу жирних кислот олійних культур, а також на гальмування процесу пом'якшення плодів після їхнього дозрівання. Наприклад, таке передчасне пом'якшення томатів зумовлене генами ферментів целюлази й полігалактуронази. Для інактивації вказаних генів за механізмом РНК-інтерференції було створено трансгенні рослини, в яких синтезувались антизмістовні РНК-версії відповідних мРНК.
Стійкість рослин до біотичних і абіотичних факторів - інша важлива мета генетичних модифікацій. Наразі найширше культивуються трансгенні рослини, що є стійкими до дії гербіцидів і комах. Дія гербіцидів головним чином виявляється в інгібуванні біохімічних процесів фотосинтезу або синтезу амінокислот. З появою технології генетичної трансформації стало можливим убудовувати в рослини гени, які роблять їх нечутливими до таких гербіцидів: після обробки гербіцидом бур'яни гинуть, а трансгенні культури - ні. Сьогодні виведено велику кількість трансгенних рослин, стійких до основних класів гербіцидів. При створенні їх було реалізовано щонайменше три різні підходи: 1) забезпечити синтез білка, чутливого до дії гербіциду, у такій кількості, щоб його вистачило на виконання властивих йому функцій за наявності гербіциду; 2) зменшити здатність білка, чутливого до гербіциду, до зв'язування з ним; 3) забезпечити інактивацію гербіциду в рослині в ході метаболізму.
Використання генної інженерії дозволяє також конструювати рослини, стійкі до комашиних атак. Так, тепер широко використовують гени Bacillus thuringiensis - ґрунтового мікроорганізму, що має здатність у ході споруляції утворювати асоційовані зі спорами кристалоподібні включення, які складаються з так званих Cry-білків -токсинів проти комах. Мінімальний фрагмент гена такого бактеріального токсину, оздоблений сильним промотором, інтегрується в рослинний геном - таким шляхом уже отримано стійкі до комах форми картоплі, томатів, хлопку, кукурудзи тощо. Найважливіше, що при цьому зникає необхідність у використанні інсектицидів. Розроблено також інші системи захисту від комах на основі введення генів інгібіторів протеаз, які блокують гідроліз рослинних білків у траво-ході комахи.
Генетичною інженерією рослин широко послуговуються також для створення культур, стійких до фітопатогенних вірусів, соле- та посухостійких трансгенних рослин. Так, одержано трансгенний рис з ін-активованим геном Fad7 (білок, що впливає на метаболізм жирних кислот), який може рости при підвищених температурах і витримувати до двох годин при 47 °С.
Перспективним напрямком є також створення трансгенних рослин, що синтезують цінні речовини. Рослини дають велику кількість біомаси, і, на відміну від рекомбінантних бактерій, для вирощування сільськогосподарських культур не потрібні великі кошти на обладнання та висококваліфікований персонал. Ще одна перевага транс-генних рослин як продуцентів фармакологічних білків - висока якість отриманого продукту й майже повна відповідність систем посттранс-ляційних модифікацій білків до таких, що реалізуються в організмі людини. Сьогодні вже створено трансгенні рослини-продуценти мо-ноклональних антитіл, функціональних фрагментів антитіл, гормонів, цитокінів, факторів росту, інтерферону, інших білків із фармакологічною дією. Загалом, незважаючи на значні досягнення в області продукування рекомбінантних білків медичного значення в рослинах, цей напрямок перебуває лише на початковій стадії свого розвитку. Вважається, що в майбутньому рекомбінантні препарати, які отримуватимуть з генетично модифікованих рослин, замінять на фармацевтичному ринку вартісні аналоги, одержані з тварин і бактерій.
Генетична інженерія тварин
Генетично модифікованих тварин отримують за допомогою мік-роін'єкції ДНК у запліднену яйцеклітину; уведення генетично модифікованих ембріональних стовбурових клітин в ембріон на ранніх стадіях розвитку; пересадження генетично-модифікованих ядер соматичних клітин в енуклейований овоцит. Після введення ДНК яйцеклітини, бластоцити чи овоцити імплантують мікрохірургічним шляхом у "сурогатну" матір (рис. 9.11).
Після народження тварин їх ідентифікують на наявність трансгену за допомогою ПЛР і гібридизації за Саузерном (у середньому на 100 вагітностей отримують одну трансгенну тварину). Щоб визначити, чи знаходиться трансген у клітинах зародкової лінії тварин, трансгенну тварину схрещують із звичайними. Далі можна схрещувати нащадків для отримання чистих трансгенних ліній: увесь процес є досить тривалим - наприклад, для отримання невеликої групи трансгенних кіз потрібно півтора року.
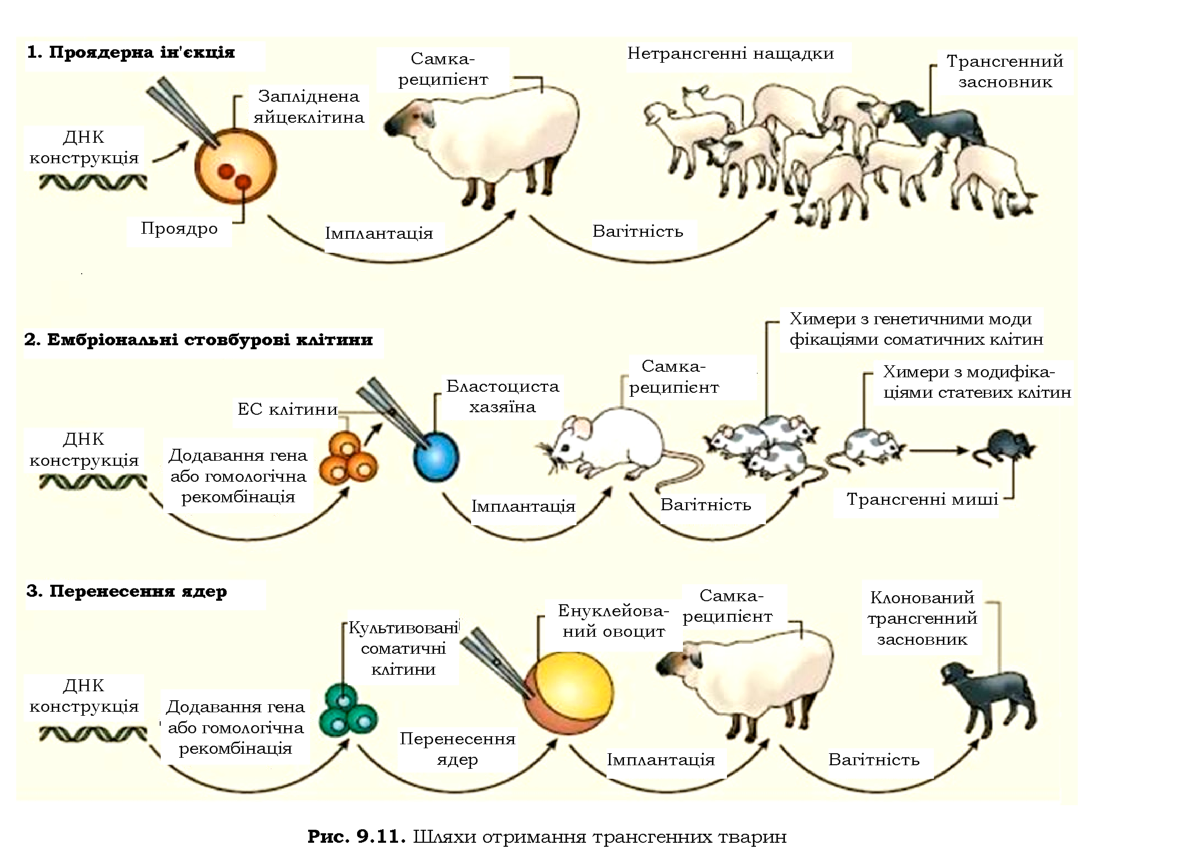
Процес пересадження ядер соматичних клітин в енуклейовані яйцеклітини називають також клонуванням (отримання генетично однорідного потомства від однієї родоначальної клітини). Для клонованих тварин характерний високий рівень пре- і постнатальної смертності, а також поява різних аномалій, що пов'язують з епігенетичною спадковістю. Отже, хоча роботи з клонування тварин мають вагомий науковий інтерес, їхня практична цінність наразі залишається невисокою.
Незважаючи на деякі успішні спроби, загалом поки що не вдалося отримати вражаючих результатів щодо збільшення швидкості росту сільськогосподарських тварин, підвищення надоїв і поліпщення якості продукції методами генетичної інженерії. Але використання трансгенних тварин - кіз, овець, свиней, кролів - як біореакторів розвивається досить інтенсивно (відповідні методики генетичної модифікації відпрацьовують зазвичай на мишах). Синтез необхідних для медицини білків (які виділяються трансгенною твариною просто в молоко) в організмі ссавців позбавлений усіх недоліків отримання рекомбінантних білків в культурах бактерій і навіть рослинах: системи посттрансляційних модифікацій є практично ідентичними в усіх ссавців. Перелік трансгенних лікарських білків, що їх сьогодні отримують із молока, уже досить великий. Це фактори згортання крові, фібриноген, a-1-антитрипсин, колаген, інтерферони, а-глюко-зидаза, кальцитонін, лактоферин і багато інших. Запропоновано навіть спеціальний термін "фармінг" для позначення процесу отримання з молока свійських тварин аутентичних білків людини та фармацевтичних препаратів. Біореакторами можуть бути також курячі яйця. Уже отримано модифікованих птахів, що відкладають яйця, які містять деякі білки людини.
Важливим напрямком є також створення трансгенних тварин як генетичних моделей спадкових захворювань людини. Після установлення гена, імовірно відповідального за дане захворювання, можна створити два типи модельних тварин: це миші з функціональним трансгеном і миші, в яких функція даного гена втрачена. Перший тип - це класичні трансгенні миші, у геном яких уведено ген людини, відповідальний за конкретне захворювання. Якщо схильність до захворювання залежить від наявності в геномі одного з багатьох алелів, то створюються лінії трансгенних мишей, що несуть різні алелі даного гена. На цих моделях можна досліджувати вплив кількості копій гена та рівня його експресії на прояв захворювання, а також розробляти нові методи лікування. Другий тип модельних тварин - це миші, у котрих вимкнено ген (генний нокаут), аналогічний тому, який викликає дане захворювання в людини. На такій моделі досліджують конкретні функції генів, що особливо важливо для аналізу причин мультигенних захворювань.
Генна терапія
Концепція генної терапії полягає в тому очевидному твердженні, що найрадикальнішим способом боротьби з різного роду захворюваннями, викликаними змінами генетичної інформації клітин, має бути виправлення або знищення самої генетичної причини захворювання, а не її наслідків. Такою може бути мутація в зародковій лінії клітин, яка передається нащадкам; або соматична мутація, що викликає, наприклад, злоякісну трансформацію; або поява в клітині чужорідного генетичного матеріалу унаслідок вірусної інфекції. Спосіб боротьби із цими генетичними змінами полягає в штучному введенні в постраж-далу клітину нової генетичної інформації, покликаної виправити ту, з якою пов'язана хвороба. Історично генна терапія спочатку націлювалася на лікування спадкових генетичних захворювань, однак згодом поле її застосування, принаймні теоретично, розширилося таким чином, що вона стала розглядатися як потенційно універсальний підхід до лікування практично всього спектра хвороб.
Стратегії генної терапії можна розділити на три великі блоки. Стратегія першого типу використовується в тих випадках, коли клітини, які потрібно вилікувати, втратили функцію певного гена. Тоді в клітину, що страждає від втрати функції, потрібно доставити ген, здатний забезпечити її. Часто хвороба, навпаки, викликається надлишковою функцією, не властивою нормальній клітині. Це, зокрема, відбувається при інфекціях або пухлинних трансформаціях. Тоді варто сконцентрувати увагу на пригніченні зайвої функції. Ці дві стратегії можна вважати суто генно-терапевтичними: вони спрямовані на корекцію дефекту клітини шляхом її генетичної модифікації. Підходами третього типу є такі, що спрямовані на підсилення імунної відповіді організму на небажані явища. При цьому також здійснюється генетична модифікація або тих клітин, проти яких хочуть збільшити імунну відповідь, або клітин імунної системи, за допомогою котрих хочуть підсилити цей ефект.
Існує кілька способів уведення нової генетичної інформації в клітини ссавців. Зазвичай використовують два основні підходи, які різняться природою клітин-мішеней:
1) фетальна генотерапія - при якій чужорідну ДНК уводять у зиготу або ембріон на ранній стадії розвитку; при цьому очікується, що введений матеріал потрапить в усі клітини реципієнта, у тому числі -статеві, забезпечивши тим самим передачу наступному поколінню);
2) соматична генотерапія - у цьому разі генетичний матеріал уводять тільки в соматичні клітини і він не передається статевим клітинам.
Є й третій підхід - активація власних генів організму з метою повного або часткового подолання дії мутантного гена. Яскравим прикладом такого підходу є використання гідроксисечовини для активації синтезу гемоглобіну F у хворих із серповидноклітинною анемією та таласеміями.
Більшість методів фетальної генотерапії розроблені на трансген-них мишах і вони дають іноді непогані результати. Але низький вихід трансгенних тварин, небезпека ушкодження генів хазяїна при неадресному вбудовуванні чужорідної ДНК, а також зрозумілі етичні проблеми роблять фетальну генотерапію поки що не актуальною.
Щодо соматичної генотерапії, то сьогодні на стадії розробки (а іноді й клінічних випробувань) існує кілька сотень проектів, спрямованих на лікування онкологічних, інфекційних (СНІД, гепатит, туберкульоз) і спадкових захворювань.
Є різні методи введення чужорідної ДНК у клітини-мішені - вибір частково залежить від захворювання. Доставку генетичного матеріалу здійснюють, застосовуючи вектори на основі вірусів (ретровірусів, не здатних до самостійної реплікації, аденовірусів, герпесвірусів тощо) або за допомогою безвекторних систем, зокрема ліпосом. Існує два підходи соматичної генотерапії. Перший - генна терапія ex vivo: спочатку генетичний матеріал уводять у клітини, які вирощують у культурі, а потім трансгенні клітини вводять реципієнтові. Другий - генна терапія in vivo: вектор, що несе потрібний ген, уводять безпосередньо в організм реципієнта. Перший підхід особливо ефективний, якщо для доставки використовують стовбурові кровотворні та інші клітини, які вдається виростити в культурі у великих кількостях.
До 80 % усіх сучасних розробок генної терапії припадають на пухлинні захворювання. Як найбільш перспективні сьогодні розглядають такі напрямки боротьби з онкологічними захворюваннями:
1) збільшення імуногенності пухлинних клітин, наприклад, шляхом уведення генів, що кодують чужорідний для цих клітин антиген;
2) уведення в пухлинні клітини "генів-убивць", які запускають програму загибелі або відповідають за синтез продукту, що приводить у певних умовах до загибелі пухлинних клітин; 3) блокування експресії онкогенів шляхом, скажімо, уведення в клітини конструкцій, які кодують синтез антизмістовних РНК або антитіл до онкобілків; 4) захист стовбурових клітин від токсичних ефектів хіміотерапії шляхом уведення в них генів стійкості до ліків.
Особливе місце посідають розробки, спрямовані на боротьбу зі СНІДом. СНІД - незвичайне інфекційне захворювання, оскільки в цьому випадку генетичний матеріал збудника потрапляє в геном і залишається там до кінця існування клітини. Сьогодні використовують два головні підходи для генотерапії СНІДу: внутрішньоклітинну імунізацію та підвищення імунності проти вірусу з використанням генетично модифікованих клітин. Термін "внутрішньоклітинна імунізація" означає процес створення клітин, здатних продукувати внутрішньоклітинні антитіла проти збудника після введення в клітину відповідної генетичної інформації. Внутрішньоклітинні антитіла відкривають унікальний засіб впливу зсередини клітини на будь-які внутрішньоклітинні об'єкти - білки, цукри або нуклеїнові кислоти.
Для багатьох інфекційних збудників показано, що існують певні лінії їхніх клітин-хазяїв, які не інфікуються або не підтримують реплікацію даного збудника. Так, у 10 % представників європеоїдної раси є мутантний вірусний корецептор СКЫ5 і гомозиготні за відповідним геном індивідууми не інфікуються ВІЛ-1. Запропоновано декілька варіантів використання цих даних для боротьби з інфекцією: запобігання інфекції шляхом блокування рецепторів, пригнічення експресії корецептора або його спрямована делеція.
У багатьох випадках захворювання, у тому числі й інфекційні, пов'язані з надлишковим синтезом нормального білка. Для лікування таких патологій розроблено терапевтичні системи з використанням антизмістовних олігонуклеотидів. Невеликий олігонуклеотид може гібридизуватися з комплементарною мРНК і знижувати рівень експресії білка, що відповідає за виникнення патології. Аналогічно можуть бути використані дволанцюгові РНК, що діють за механізмом РНК-інтерференції (див. розділ 2), блокуючи синтез білка на рибосомі. На відміну від антизмістовних РНК, дволанцюгові РНК - інструмент багаторазового використання, оскільки ампліфікуються в клітині РНК-залежною РНК-полімеразою.
Нарешті, одним із найважливіших напрямків застосування методів молекулярної генетики в медицині є молекулярна діагностика спадкових захворювань, у тому числі - до народження (пренатальна діагностика). Гени практично всіх спадкових захворювань уже відомі, методи їхнього визначення широко застосовуються в медицині з метою запобігти народженню хворої дитини. Методи молекулярної діагностики дозволяють виявити не тільки гени спадкових (моноген-них) захворювань (гемофілія, муковісцидоз, міодистрофія Дюшенна, фенілкетонурія тощо), а й гени схильності до того чи іншого захворювання: хвороб, які розвиваються у старечому віці (хвороба Альцгеймера, рак молочної залози, нейродегенеративні хвороби), і таких, що виникають за дії певних зовнішніх факторів (діабет, атеросклероз, деякі онкологічні захворювання). Молекулярна діагностика дає можливість поставити діагноз задовго до появи симптомів і, відповідно, розпочати профілактику або лікування.
Розвиток методів геноміки дозволить у майбутньому проводити тотальну "генетичну паспортизацію" з метою виявлення індивідуальних ризиків кожної людини. Одним із найважливіших результатів робіт із секвенування геному людини стало суттєве вдосконалення методичних підходів. Нещодавно було здійснено секвенування першого індивідуального геному - геному Джеймса Уотсона, людини, яка стояла на початку молекулярної генетики. Цей геном було встановлено методом піросеквенування за два місяці, що коштувало менше 1 млн доларів (для порівняння: загальне фінансування проекту "Геном людини" з боку американського уряду становило близько 3 млрд доларів за 11 років). Швидкий розвиток сучасних технологій геноміки робить секвенування індивідуальних геномів кожної людини реальністю у близькому майбутньому.
Контрольні запитання і завдання
1. Укажіть основні ферменти, які використовують у генній інженерії.
2. Що таке рестриктази та як вони використовуються в рекомбінант-них технологіях?
3. У чому полягає процес клонування ДНК? Яким вимогам має відповідати плазмідний вектор для клонування і чому?
4. Що таке геномна бібліотека? Як створюються такі бібліотеки?
5. Дайте визначення кДНК. Як створюють бібліотеку клонів кДНК?
6. Що таке гібридизація? Як здійснюється гібридизація ДНК на нітроцелюлозних фільтрах?
7. Опишіть основні принципи полімеразної ланцюгової реакції.
8. Як здійснюють секвенування ДНК за Сангером?
9. Опишіть принципову схему експресії рекомбінантних білків у бактеріальних клітинах.
10. Що таке блот-гібридизація? Яка різниця між Саузерн- і нозерн-блотингом?
11. Як здійснюють фінгерпринтинг ДНК?
12. Як аналізують активність геному за допомогою ДНК-мікроареїв?
13. Назвіть продукти, які можна отримувати за допомогою генетично змінених мікроорганізмів.
14. Які методи використовуються для трансформації рослин?
15. Що таке репортерні гени? Як саме вони використовуються при трансформації рослинних клітин?
16. Назвіть основні напрямки використання генетично модифікованих рослин?
17. Як отримують трансгенних тварин?
18. Назвіть способи введення нової генетичної інформації в клітини ссавців?
19. Сформулюйте принципи лікування захворювань за допомогою генної терапії?
Автор: admin от 18-07-2013, 17:11, Переглядів: 25919