Хімічні властивості кислот
Плаваючи в Чорному морі, ми й не підозрюємо, що перебуваємо біля джерела однієї з природних кислот, адже на глибині 150-200 .« вода насичена гідрогенсульфідом HsS. Досягти цього шару не так просто, та її кислоті дістатись поверхні вдається не кожного дня. Напевне, пам'ятаєте запах Чорного моря після шторму. Що може статися, якщо все ж батискафу чи глибоководному апарата вдається досягти шару гідрогенсульфіду?
Кислоти мають спільні хімічні властивості, характерні для кислот. Крім того, деякі кислоти, такі як нітратна та концентрована сульфатна, мають особливі властивості, нро що ви дізнаєтеся пізніше.
Пригадайте! Що таке кислоти? Як класифікують кислоти?
1. Водні розчини кислот змінюють забарвлення індикаторів.
Лабораторний дослід № 4
Дія водних розчинів кислот на індикатори
Пригадайте правила безпеки під час проведення лабораторних дослідів (див. додаток 2).
1. Випробуйте розчини кислот різними індикаторами.
Обережно налийте но 1-2 мл розчину кислоти, яку запропонував
вчитель, у три пробірки. В одну пробірку додайте KLibKa крапель розчину лакмусу, у другу — метилоранжу, третю — розчин фенолфталеїну. Як змінюється забарвлення індикаторів?
До універсального індикаторного папірця доторкніться скляною паличкою, змоченою розчином кислоти. Як змінюється забарвлення?
2. Зробіть висновок, склавши таблицю забарвлення індикаторів (із графами за зразком): лакмус, метилоранж, фенолфталеїн, універсальний індикаторний папірець. Який індикатор недоречно використовувати для визначення кислоти? Чому?
|
Індикатор |
Середовище |
|
|
Нейтральне |
Кисле |
|
2. Кислоти реагують з метачами.
Кислота + метал —» сіль + водень
Атоми Гідрогену, що входять до складу кислот, здатні заміщуватися на атоми металічного елемента з утворенням солей і виділенням водню. Такі реакції називають реакціями заміщення.
Реакція заміщення — це реакція між простою та складною речовинами, у результаті якої утворюються нові проста та складна речовини.

Mg + 2НС1 = MgCl2 + H2T
Інтенсивність такої взаємодії залежить від активності металів. Реакції відбуваються лише з металами, що розташовані в ряду активності металів до Гідрогену.
Часто цей ряд називають рядом Бекетова за ім’ям видатного хіміка, професора Харківського університету Μ. М. Бекетова (мал. 67), який узагальнив результати досліджень багатьох вчених, у першу чергу Я. Берцелі-уса, який вивчав взаємодію різних металів з кислотами.
Ряд активності .металів
Li, К, Ba, Ca, Na, Mg, Al, Cr, Zn, Fe, Ni, Sn, Pb, (Н), Bi, Cu, Ag, Hg, Pt, Au
Хімічна активність металів зростає
Що лівіше розташований метал у цьому ряду, то активніше він взаємодіє з розчинами кислот. Так, цинк реагує з розбавленим розчином сульфатної кислоти активніше, ніж залізо. А мідь взагалі не взаємодіє з розбавленою сульфатною кислотою (мал. 68).

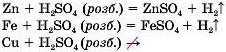
Пам’ятайте!
• Метали, розташовані праворуч Гідрогену, з розчинами кислот (за деякими винятками) взагалі не взаємодіють.
• З металами не реагують нерозчинна силікатна та нестійка карбонатна кислоти.
• Нітратна кислота — особлива. Вона реагує з усіма металами за винятком золота та платини. Під час реакцій нітратної кислоти з металами водень не виділяється!
• У разі взаємодії металів з концентрованим розчином сульфатної кислоти водень не виділяється! (З цими реакціями ви познайомитеся пізніше у подальшому вивчені хімії.)
Лабораторний дослід № 5
Взаємодія Xлорядної кислоти з металами
Пригадайте правила безпеки під час проведення лабораторних дослідів (див. додаток 2).
1. Проведіть досліди.
У три иробірки обережно налийте по 1-2 мл розбавленого розчину хлоридної кислоти. У першу пробірку додайте невелику кількість порошку магнію або магнієві ошурки, у другу — порошок заліза, цвях, або залізні ошурки. У третю — шматочок мідного дроту. Що спостерігаєте?
2. Запишіть рівняння проведених реакцій.
3. У висновку зазначте, з якими металами реакція відбувається інтенсивніше. Поясніть чому, посилаючись на ряд активності металів.
3. Кислоти реагують із солями.
Кислота 1 + сіль 1 —* сіль 2 + кислота 2
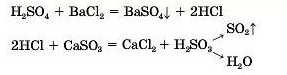
Пам'ятайте!
Реакції між кислотами та солями відбуваються, якщо:
• утворюється осад або газ;
• кислота, що утворюється, є леткою;
• кислота, що утворюється, слабша за кислоту, що вступає в реакцію.
Кислоти мають різну активність, яку досліджено науковцями, та складено ряд відносної активності кислот.
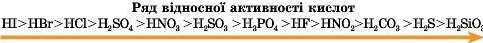
Активність кислот зменшується
4. Кислоти реагують з оснбвними оксидами і основами, амфотерними оксидами та амфотерними гідроксидами, утворюючи солі та води:
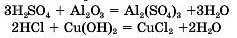
Сульфатна, нітратна, хлоридна кислоти — небезпечні, бо реагують із багатьма речовинами. Вони роз’їдають і обвуглюють деревину, напір, тканину, деякі інші матеріали, а також шкіру. На одязі бризки кислот залишають дірки. Кислоти пошкоджують тканини живих організмів, спричиняючи утворення виразок, що довію не заживають.
Працювати з кислотами потрібно обережно, використовуючи захисні окуляри та рукавички!
У випадку потрапляння кислот на шкіру потрібно промити це місце великою кількістю води та, за потреби, обробити розчином соди.
Використання кислот
Кислоти — клас неорганічних сполук, які використовують у промисловості, у хімічних лабораторіях та побуті. Так, хлоридну кислоту використовують у виробництві ліків, барвників, а також відповідних солей.
Сульфатну кислоту, яку називають «хлібом» хімічної промисловості, застосовують у металургії (у добуванні металів), виробництві мінеральних добрив, барвників, вибухових речовин, пластмас та багатьох інших органічних речовин. Сульфатну кислоту використовують навіть у харчовій промисловості як емульгатор.
З нітратної кислоти добувають мінеральні добрива, пластмаси та штучні волокна, лікарські засоби.
Закінчіть речення, вибравши 2—3, які вважаєте за потрібне: Я зрозумів (-ла), що... Було важко... Я дізнався (-лась) про... Я зумів (-ла)... Мене здивувало... Було корисно... Тепер я умію... Я не зрозумів (-ла)...
1. Яким індикатором не можна скористатися для визначення розчинів кислот? Обґрунтуйте свою відповідь.
Запитання та завдання
2. Що спільного у властивостях кислот?
3. Як визначити, який метал інтенсивніше взаємодіє з розчинами кислот?
4. Знайдіть інформацію та наведіть приклади застосування кислот у промисловості.
5. Знайдіть інформацію про застосування неорганічних кислот у харчовій промисловості.
6. У побуті для чищення поверхонь застосовують різні засоби, до складу яких входять неорганічні кислоти. Складіть пам'ятку про безпечне застосування таких засобів.
7. Перетворіть схеми реакцій на відповідні рівняння. Назвіть продукти реакцій.
Al + H2SO4 -> Mn + HCI -*
CaO + HBr -» HNO3 + Na2CO3 -»
Ni(OH)2+ HNO3 -» K2SiO3 + НІ
8. Запишіть рівняння можливих реакцій розчину оргофосфатної кислоти з магнієм, нітроген(ІІ) оксидом, нікель(ІІ) оксидом, калій гідроксидом, барій сульфатом, сріблом.
9. За допомогою яких реакцій можна здійснити перетворення? Вкажіть типи реакцій та назви продуктів реакцій.
A BaCO3 -* BaCI2 -» BaSO4 Б MgO -* Mg(NO3)2 -> Mg(OH)2 -> MgCI2
10. Обчисліть об’єм газу (н. у.), що утворився під час взаємодії цинку кількістю речовини 0,4 моль з розчином хлоридної кислоти.
11. Обчисліть кількість речовини солі, що утворилася під час взаємодії магній оксиду масою 3,2 г з розчином сульфатної кислоти.
12. Обчисліть масу осаду, що утворився під час взаємодії кальцій оксиду масою 33,6 г з розчином ортофосфатної кислоти.
13. Обчисліть об'єм газу (н. у.), що утворюється під час взаємодії розчину бромідної кислоти масою 50 г з алюмінієм. Масова частка HBr у розчині становить 3?,4 %
14. За добу у шлунку людини утворюється шлунковий сік, що містить 4,26 г хлоридної кислоти (НСІ). Обчисліть масу натрій хлориду, необхідного для утворення цієї кількості кислоти поза організмом людини за схемою:
NaCI + H2SO4 -* Na2SO4+_______
15. Восьмикласник, готуючись до лабораторної роботи, забув підписати хімічні склянки, в одній з яких була вода, другій — розчин кислоти, третій — розчин лугу. Допоможіть учню з'ясувати, у яких склянках міститься вода, кислота та луг.
16. Учень отримав практичне завдання — провести реакції, характерні лише для кислот, з речовинами: цинк оксид, розчин калій гідроксиду, розчин фенолфталеїну, алюміній, фосфор(У) оксид. Напишіть рівняння можливих реакцій, назвіть продукти реакцій.
17. Під час спалювання твердої речовини А жовтого кольору утворюється безбарвний газ Б з неприємним запахом. Розчиняючись у воді, він утворює нестійку неорганічну кислоту В, яка навіть за незначного нагрівання розкладається на газ Б і воду. Встановіть речовини та складіть рівняння відповідних реакцій.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:23, Переглядів: 3025