Хімічні властивості основ
Чому в хімічних властивостях основ є спільне і відмінне?
Клас основ цікавий тим, що луги та нерозчинні основи, що відрізняються за фізичними властивостями, мають також і відмінні хімічні властивості. Тому ми будемо розглядати окремо реакції, що характерні для лугів і нерозчинних основ. Незначна присутність основ у природі обумовлена їхньою реакційністю, тобто хімічними властивостями.
Пригадайте! За якою ознакою вирізняють основи серед сполук інших класів? Як класифікують основи?
Розчини лугів, потрапляючи на шкіру або тканини, роз’їдають їх, тому луги називають їдкими сполуками.
Часто хіміки вживають такі назви: їдкий натр, їдке калі. Вони яскраво відображають фізіологічну дію лугів.
Пам’ятайте! Якщо розчин лугу потрапив на шкіру, потрібно негайно промити місце ураження великою кількістю води. За потреби обробити слабким розчином борної кислоти(J чайна ложка на склянку води). У разі сильного хімічного опіку звернутися до лікаря чи шкільної медсестри.
Хімічні властивості лугів
1. Розчини лугів змінюють кольори індикаторів
Лабораторний дослід № 2
Дія водних розчинів лугів на індикатори
Пригадайте правила безпеки під час проведення лабораторних дослідів (див. додаток 2).
1. Випробуйте розчини лугів різними індикаторами.
Обережно налийте но 1-2 мл розчину лугу у три пробірки. У першу пробірку додайте кілька крапель розчину лакмусу, у другу — метилоранжу, третю — розчин фенолфталеїн у. Як змінюється забарвлення індикаторів?
2. До універсального індикаторного папірця доторкніться скляною паличкою, змоченою розчином лугу. Як змінюється забарвлення універсального індикаторного папірця? Занотуйте результати у таблицю.
|
Індикатор |
Середовище |
|
|
Нейтральне |
Лужне |
|
|
Лакмус |
||
|
Метилоранж |
||
|
Фенолфталеїн |
||
|
Універсальний індикаторний папірець |
||
2. Луги реагують з кислотними оксидами.
Луг + кислотний оксид —> сіль + вода
2NaOH + SO2 = Na2SO3+ II2O II2SO3 натрій сульфіт
3. Луги реагують з кислотами.
Луг + кислота —* сіль + вода
Луги і кислоти мають полярні чи протилежні середовища. Під час їх взаємодії відбувається реакція обміну, яку називають реакцією нейтралізації.
Ca(OII)2 + H2SO4 = CaSO4 + 2И20
Реакція нейтралізації — це реакція між основою та кислотою, у результаті якої утворюються сіль і вода.
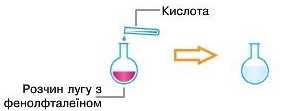
Лабораторний дослід № З
Взаємодія лугів з кислотами в розчині
Пригадайте правила безпека під час проведення лабораторних дослідів (див. додаток 2).
1. Повторіть правила безпеки під час роботи з лугами та кислотами.
2. У пробірку з розчином лугу, що містить кілька крапель фенолфталеїну і має малинове забарвлення, додайте краплями розчин кислоти. Що ви спостерігаєте?
3. Запишіть рівняння відповідної реакції. У висновку вкажіть, чому змінюється забарвлення індикатора та які продукти реакції утворюються.
4. Луги реагують з розчинами солей, якщо утворюються сіль або основа, що нерозчинні у воді.


Це хімічне перетворення можна спостерігати на досліді. Якщо до розчину натрій сульфату обережно додавати розчин барій гідроксиду, утвориться густий білий осад (мал. 65).
5. Луги розкладаються лише за дуже високих температур. Проте існує виняток — кальцій гідроксид, який легко розкладається на кальцій оксид і воду.
Хімічні властивості нерозчинних основ
1. Нерозчинні основи розкладаються за нагрівання.

13C
Нерозчинна основа —* основний оксид + вода
Якщо свіжонідготовлений синій осад купрум(ІІ) гідроксиду нагріти, спостерігаємо утворення чорного осаду кунрум(ІІ) оксиду (мал. 66).
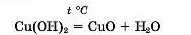
2. Нерозчинні основи реагують з розчинами кислот.
Нерозчинна основа + кислота —* сіль + вода
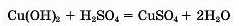
Пам’ятайте!
• На відміну від лугів, нерозчинні основа не змінюють забарвлення індикаторів.
• Нерозчинні основи не реагують із розчинами солей.
Використання основ
У промисловості та господарстві застосовують переважно луги, особливо натрій або калій гідроксиди та відомий вам кальцій гідроксид вгашене вапно». Так, натрій гідроксид здавна використовували у виробництві твердого мила, паперу та шкіряній промисловості.
Калій гідроксид використовують для виготовлення тугоплавкого скла, рідкого мила та паперу.
Кальцій гідроксид як вгашене вапно» використовують у будівництві. Прозорий розчин кальцій гідроксиду, який називають «вапняна вода», використовують для очищення цукрової сировини, якісному визначенні вуглекислого газу. Розчин (суспензію) кальцій гідроксиду «вапняне молоко» використовують для побілки стін, стовбурів дерев. Разом з мідним купоросом він утворює «бордоську суміш», яка на присадибних ділянках допомагає боротися зі шкідниками плодових культур та овочів.
Барій гідроксид «баритову воду» використовують для якісного та кількісного виявлення вуглекислото
газу.
Попрацюйте в парах. Складіть діаграму Вена за
зразком.
Хімічні властивості основ 12

Fe(OH)/-? Ni(OH)2 + HBr -.
Mg(OH)2 + CO2 -* KOH + FeSO4 -*
Mn(OH)2 + HNO3 -» Ca(OH)2 + H2SO4 -»
3. Запишіть рівняння двох реакцій між калій гідроксидом і розчинними солями Нікелю(ІІ) і Феруму(ІІ). Позначте, які продукти реакцій випадають в осад.
4. За допомогою яких реакцій можна здійснити перетворення? Вкажіть типи реакцій та назви продуктів реакцій:
а) Ba -* BaO -* Ba(OH)2 -» BaS;
б) Fe(OH)2 FeSO4 -* Fe(OH)2 -* FeO FeCI2.
5. Обчисліть масу осаду, що утворився за взаємодії калій гідроксиду кількістю речовини 0,4 моль з цинк хлоридом.
6. Складіть рівняння реакції, що відбувається під час пропускання повітря через баритову воду, якщо з часом у розчині виникає білий осад.
7. Обчисліть об'єм вуглекислого газу, що поглинається розчином барій гідроксиду масою 34,2 г.
8. Обчисліть масу осаду, що утворюється в результаті змішування надлишку солі манґан(ІІ) хлориду з розчином лугу, масою 200 г, з масовою часткою натрій гідроксиду 10 %.
9. Сірководень є сильною отрутою, тому цей газ, що утворюється на різних виробництвах, поглинають за допомогою твердих поглиначів, що містять ферум(ІІІ) гідроксид. Який об’єм сірководню H2S поглинається ферум(ІІІ) гідроксидом масою 25,68 г? Розрахунки проведіть за схемою (складіть формулу продукту реакції):
пі її
Fe(OH)3 + H2S -» Fe S + H2O
10. Які з речовин реагують з барій гідроксидом? Запишіть рівняння можливих реакцій.
A CuSO4 Б CuO В SO2 Г H2SO4 Д Fe(OH)2
11. Чому зберігати кристалічні луги потрібно в герметично закритому посуді? Запишіть рівняння реакцій, що можуть відбуватись під час зберігання калій гідроксиду на повітрі.
12. Натрій гідроксид кількістю речовини 0,2 моль розчинили у воді об’ємом 160 мл. Обчисліть масову частку лугу в утвореному розчині.
13. Наведіть приклади застосування основ, ґрунтуючись на їхніх хімічних властивостях і використовуючи достовірну інформацію з інтернету.
14. Розгляньте ситуацію та запропонуйте порядок надання допомоги:
Батько прочищав стічні труби на кухні, але знехтував правилами безпеки і не надів рукавички. Гранули засобу для промивання стічних труб — натрій гідроксид, потрапили йому на шкіру. Він не помітив цього відразу, а звернув увагу лише тоді, коли відчув подразнення. Як допомогти батькові?
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:23, Переглядів: 4108