Молярний об'єм газів
Чи однаковий об’єм займатиме 1 моль льоду? 1 моль води? 1 моль водяної пари?
Термін «газ» увів голландець Ян Баптист ван Гельмонт на початку XVII ст. Слово має походження від грец. хаос, що означає безформний стан.
Наше життя проходить у газовому середовищі — повітрі, що є сумішшю кількох газів. У давнину повітря вважалось речовиною, індивідуальним газом. Вивчення газів розпочалось не так давно. Перші газові закони були відкриті протягом XVH-
XIX ст.
Пригадайте! З яких газів складається повітря? Без якого газу існування всіх живих організмів неможливе?
Зазвичай під час обчислень, що пов’язані із газами, використовують фізичну величину — об’єм.
Пригадайте! Які одиниці вимірювання об'єму вам відомі?
Закон Лвогадро
Молекули в газах знаходяться на значних відстанях одна від одної та перебувають у постійному русі. Якщо порівнювати ці відстані із розмірами молекул, то останніми можна знехтувати. Це суттєво відрізняє гази від рідин і твердих тіл. Під час переходу речовини з рідкого стану в газуватий відстані між молекулами збільшуються в десятки разів. Об’єм газу визначають відстанями між молекулами. За однакових температури й тиску для усіх газів ці відстані приблизно однакові.
Амед£о Авогадро, використавши опубліковані матеріали щодо дослідження газів, припустив, що однакові
об’єми будь-яких газів містять однакове число молекул.
Так він сформулював важливий газовий закон, що має назву закон Авогадро:
В однакових об’ємах газів за однакових умов міститься однакове число молекул.
Якщо розглянути зворотне твердження, то одержимо наслідок із закону Авогадро:
Будь-які гази кількістю речовини один моль за однакових умов займають однаковий об’єм.
Зазвичай вимірювання проводять за нормальних умов, іноді за стандартних умов.
Нормальні умови (н. у.): Стандартні умови:
• t = 0°C; · t = 25°С;
• тиск 101325 Па, або · тиск 1 атм. або 760 мм 1 атм., або 760 мм ртут- ртутного стовнчика ного стовпчика
Молярний об’єм газів
Об’єм газу, що містить за нормальних умов (н.у.) число частинок, яке дорівнює числу Авогадро, тобто об’єм 1 моль газу, називають молярним об’ємом. Цей об’єм за нормальних умов становить 22,4 л. Відповідну постійну величину називають молярним об’ємом газів. Її позначають Vm і вона чисельно дорівнює 22,4 л/моль.
Vm = 22,4 л/моль
KLibKicTb речовини та об’єм газу поєднані фізичною сталою — молярним об’ємом газів через формулу:
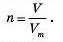
З неї можна вивести формулу для обчислення об’єму газу за відомою кількістю речовини:
V= п-Vn.
Обчислення об’єму газу за нормальних умов за відомою кількістю речовини
Приклад 1. Обчисліть об’єм водню (н.у.) кількістю речовини 0,2 моль.

Відповідь: 0,2 моль водню за нормальних умов займає об’єм 4,48 л.
Обчислення числа частинок (атомів, молекул, йонів) у певному об’ємі.
Приклад 2.Обчисліть число молекул кисню об’ємом 6,72 л (н. у.).
Розв’язування

Відповідь: у 6,72 л кисню міститься 1,806-1023 молекул за н. у.
Обчислення об’єму газу за нормальних умов за відомою масою
Приклад 3.Обчисліть об’єм озону (н. у.) масою 9,6 г.
Розв’язування

Відповідь: озон масою 9,6 г займає об’єм 4,48 л за н. у.
юв справедливо лише для газів, ігрегатних станах: твердому, і маси та кількість речовини.

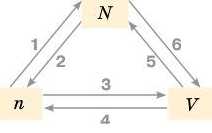
Попрацюйте в парах. Проаналізуйте схему взаємозв’язку фізичних величин і наведіть відповідні формули можливих обчислень.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:00, Переглядів: 1909