Кристалічні гратки
Відомо, що у природі все взаємопов'язано. Який же зв’язок існує .між типом хімічного зв’язку, будовою речовини та її властивостями?
Хімія в нашому житті
Напевне, ще у дошкільному віці ви запитували старших:
• чому вода влітку рідка, а взимку перетворюється на лід?
• чому повітря завжди — і влітку, і взимку — газувате?
• чому вода в чайнику закипає й перетворюється на пару, а металевий посуд від нагрівання на плиті навіть не плавиться?
Ми усі дихаємо газуватим повітрям, але небагатьом дорослим доводилось бачити рідке повітря, а тим більше кристалічне. Повітря кристалізується за температури приблизно (-220 °С). Рідке повітря використовують для добування чистого кисню для промислових потреб. Поступово збільшуючи температуру, спочатку випаровують азот, який кипить за температури (-196 °С), а потім кисень — (-383 °С).
За звичайних умов лише ртуть — це рідкий метал. Для розплавленая алюмінію потрібна температура +660 cC , а залізо потрібно нагріти до +1539 °С.
Пояснити таке розмаїття властивостей речовин, що нас оточують, можна різними хімічними зв’язками та їхньою будовою. Молекули газів, що легко переміщуються у просторі (за рахунок дифузії), та рідин, що можуть перемішуватись одна з одною (за винятком тих, що не розчиняються одна в одній) не пов’язані між собою міцними зв’язками.

У твердих речовинах частинки мають певний порядок розміщення.
Чи доводилось вам роздивлятись звичайну сніжинку? Яка вона красива й довершена. Більшість сніжинок дуже схожа. Вони мають правильну шестикутну форму (мал. 46).
У природі існують тверді тіла — кристали, складові частинки яких розміщені у чіткому порядку. Якщо через центри частинок провести лінії, утвориться кристалічна ґратка. Точки, у яких перетинаються лінії, називають вузлами кристалічної ґратки.
Кристали льоду та солі прозорі, але на долоні сні-
Кристалічна ґратка — це модель кристала, що ілюструє його вну-ірішній каркас.
жинка розтане, а сіль ні. Отже, зовнішня схожість не завжди означає подібність властивостей.
Пригадайте! З якої речовини утворене сніжинка?
Наведіть приклади зовні схожих речовин та опишіть їхні фізичні
властивості.
Будь-яка кристалічна речовина побудована з багаторазово повторюваних структурних одиниць. Тип кристалічної ґратки визначається частинками, що розміщені у її вузлах: молекулярні, атомні, йонні та металічні (про останні ви дізнаєтесь пізніше).
|
Кристалічні ґратки |
|||
|
Типи |
Молекулярні |
Атомні |
Йонні |
|
Складові |
молекули |
атоми |
катіони й аніони |


Молекулярні кристалічні ґратки у вузлах містять молекули, що утримуються слабкими силами міжмолекулярної взаємодії. Ці сполуки легкоплавкі й леткі, тому за звичайних умов це переважно рідини або гази. Тверді сполуки мають низьку механічну .міцність, наприклад, цукор C12H22O11. Вони легко переходять з одного агрегатного стану в інший, деякі навіть, пропускаючи рідкий стан, сублімуються, наприклад, йод І2та «сухий лід* — кристалічний вуглекислий газ CO2 (мал. 47). Молекулярні кристалічні ґратки мають прості речовини немета-лічних елементів, за винятком Силіцію та Карбону, а також деякі органічні речовини, наприклад метан CH4. У молекулах цих сполук ковалентний зв’язок.
Сублімація (від лат. sublimo — возгонка) перехід речовини із твердого стану в газуватий, оминаючи стан рідини.
Пригадайте! Які прості речовини за звичайних умов є рідинами?
Атомні кристалічні ґратки
Речовин з атомними кристалічними ґратками небагато. Це силіцій, прості речовини Карбону: алмаз (мал. 48), графіт та деякі складні речовини — пісок (SiO2), кальцій карбід (CaC2) та ін. Такі речовини дуже тверді, тугоплавкі, нерозчинні ні в яких розчинниках. Атоми у вузлах кристалічних ґраток сполучені міцними ковалентними зв’язками (мал. 49).
Алмаз — найтвердіший мінерал серед природних, ним можна різати інші мінерали, скло (мал. 50). Його температура плавлення (без доступу повітря) становить
3500 °С.
Проте необережний удар може розбити це диво природи на дрібні камінчики.
|
Період |
Група |
|||||||
|
І |
Il |
III |
IV |
V |
Vl |
Vll |
Vlll |
|
|
1 |
H2 |
Не |
||||||
|
2 |
Li |
Be |
В |
С |
N* |
O2 |
F2 |
Ne |
|
3 |
Na |
Mg |
Al |
Si |
P.. |
S |
Cl2 |
Ar |
|
4 |
K |
Ca |
Ga |
Ge |
As |
Se |
Br2 |
Kr |
|
5 |
Rb |
Sr |
In |
Sn |
Sb І |
Те |
I2 |
Xe |
|
Тип кристалічної ґратки |
металічна |
атом на |
молекулярна |
|||||
Йонні кристалічні ґратки



Пам’ятайте! Типи кристалічних ґраток простих речовин.
Речовини з йонною кристалічною ґраткою у вузлах містять протилежно заряджені йони, які утримуються завдяки електростатичній взаємодії. Вони мають високі температури плавлення та кипіння, майже нелеткі. Такі речовини по-різному розчиняються у воді. Розчини та розплави проводять електричний струм.
Пригадайте! Між частинками яких елементів може утворитись йонний зв'язок? 4
та аніони Хлору, причому катіони завжди оточені аніонами і навпаки (мал. 54).
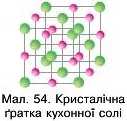
Отже, тини хімічного зв’язку виливають на кристалічну будову речовин, а будова зумовлює їхні властивості.
Лабораторний дослід № 1
Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови
Пригадайте правила безпеки під час проведення лабораторних дослідів (див. додаток 2).
Проведіть досліди:
1. Відберіть невеликі норції кухонної солі NaCl, цукру C12H22O11Ta піску SiO2Ha предметні скельця чи у порцелянові чашки. Нагрівайте речовини у полум’ї пальника обережно, протягом кількох хвилин. Спостереження запишіть у таблицю за зразком, вказуючи, які з речовин тугоплавкі чи легкоплавкі.
2. Дослідіть, чи розчиняються кухонна сіль, цукор і пісок у воді. Для цього помістіть невеликі порції (на кінчику шпателя) речовин у хімічні стакани, додайте води та перемішайте скляною паличкою (зі шматочком гумової трубочки). Спостереження запишіть, вказуючи, які з речовин розчинні чи нерозчинні у воді.
|
Дослід |
Спостереження |
||
|
Кухонна сіль |
Цукор |
Пісок |
|
|
Нагрівання речовин |
|||
|
Розчинення у воді |
|||
Зробіть висновки щодо кристачічних ґраток досліджуваних речовин.
Встановлені відмінні властивості цих речовин підтверджують різницю у їхній будові. Ці три речовини мають різні типи хімічного зв’язку і відмінні кристалічні ґратки. Отже, зв’язок між структурними частинками кухонної солі — йонної сполуки та піску, речовини з атомною кристалічною ґраткою — міцний, а в цукрі сили міжмолекулярної взаємодії невисокі.
Існують тверді речовини, наприклад, скло, що не мають кристалічної ґратки. Це аморфні речовини. До них відносять також шоколад, віск, парафін, мед, бурштин, перли.
5. Складіть узагальнювальну таблицю (за зразком) про типи кристалічних ґраток, описуючи властивості речовин:
6. Встановіть вірогідні типи кристалічних ґраток для таких сполук: NaF, Ni. CaCi, Qv HfS, С, HI, NafS, ZnCIflSIOf.
7. Спрогнозуйте властивості сполук Із попереднього завдання.
8. Які типи кристалічних ґраток мають речовини, що використовують в побуті: оцтова кислота, нафталін, крейда?
9. Елемент І групи головної підгрупи утворює сполуку з Бромом, розплав якої під дією електричного струму розкладається на прості речовини. Визначте вихідну речовину, встановіть тип хімічного зв’язку, кристалічної ґратки та складіть електронну формулу цього елемента, якщо його масова частка складає 0,223.
10. Знайдіть інформацію про український бурштин, його родовища, особливості забарвлення та ювелірну цінність.
Навчальний проект
Об'єднайтесь у групи, як пропонує учитель, обговоріть питання, щоб з’ясувати актуальність тематики навчального проекту про залежність фізичних властивостей речовин від типів кристалічних ґраток.
Придумайте назву проекту, складіть план його реалізації, перелік необхідного для цього обладнання, список тих осіб які можуть допомогти, розподіліть між собою обов’язки і завдання.
Обговоріть свої плани з учителем та приступайте до реалізації проекту.
Узагальнюємо набуті знання з теми «Хімічний зв'язок і будова речовини»
У завданнях 1-13 вкажіть одну правильну відповідь.
1. Установіть ряд елементів, що розташовані в порядку зростання значень електронегативностей.
A Ο, Ν, C BN, R As В I1 Br. Cl Г U1 Na, K
2. Укажіть тип хімічного зв'язку в молекулі йоду.
А ковалентний полярний
Б ковалентний неполярний В йонний
3. Укажіть тип хімічного зв'язку в молекулі гідрогенсульфіду.
А ковалентний полярний
Б ковалентний неполярний В йонний
4. У молекулі води спільна електронна пара зміщена до А атома Гідрогену
Б атома Оксигену
В розташована симетрично обох атомів
5. Укажіть формулу сполуки з ковалентним неполярним зв'язком.
A Na Б Na2O В N2 Г N2O
6. Укажіть формулу сполуки з ковалентним полярним зв’язком.
A H2 Б NaH В PH3 Г NH3
7. Укажіть формулу сполуки з йонним зв’язком.
A Cl2 Б CI2O В KCI Г HCI
8. Зазначте елементи, між якими утворюється йонний зв’язок.
A Ca та F Б P та O В F та F Г N та Cl
9. Укажіть йон, електронна будова якого збігається з електронною будовою атома Аргону.
A O2 Б Mg2* В Al3" Г S2'
10. Що спільного в будові атома Na" та йона Na*.
А кількість електронів
Б кількість протонів В кількість нейтронів
Г кількість електронів на зовнішньому енергетичному рівні
11. Укажіть речовину з атомною кристалічною ґраткою.
А вода Б графіт В залізо Г кальцій хлорид
12. Укажіть речовину з молекулярною кристалічною ґраткою.
А натрій хлорид Б вуглекислий газ В кисень Г алмаз
13. Укажіть речовину з йонною кристалічною ґраткою.
А графіт Б натрій хлорид В вода Г залізо 5
15. Йоном елемента та електронною формули.
Йон елемента Електронна формула
1 Na* A Is2
2 К* Б 1s22 s22 рЕ
3 Н* В 1s22 s22 рЕ3 s23 рь
4 Li* Г 1s°
Д 1s22 s22 pE3 s'
16. Типом кристалічної ґратки та формулою речовини.
Тип кристалічної ґратки Формула речовини
1 йонна A N2
2 атомна Б SiO2
3 молекулярна В KCI
Г Ca
17. Йоном елемента та кількістю протонів й електронів.
Йон елемента Кількість протонів й електронів
1 Br А 19р* та 20е
2 К* Б 26р* та 24е*
3 Al3- В 13р* та 16е·
4 Fe2" Г 36р* та 37е
Д 13р* та 10е·
E 19р* та 18е·
18. Типом кристалічної ґратки та властивістю речовини.
Тип кристалічної гратки Властивість речовини
1 йонна А леткі
2 атомна Б проводять електричний струм
3 молекулярна В дуже тверді
Г перетворюються на рідину
Завдання з відкритою відповіддю.
19. Установіть тип хімічного зв’язку в сполуках: PH31 CaBr2, SO2. За допомогою спрощених електронних формул зазначте процес утворення хімічного зв’язку.
20. У наведених формулах сполук визначте ступені окиснення: CrS1 Cr2O3l CrBr2l K2Cro41 U2SO31 Cr.
21. Установіть елементи, що мають електронні формули: 1s22s22pE3s' та 1s?2s32p4. Запишіть формулу сполуки, що утворена атомами цих елементів, і вкажіть тип хімічного зв’язку.
22. Установіть елементи, що мають електронні формули: 1 s22s22pE3s23p4 та 1s22s22pE. Укажіть тип хімічного зв’язку, що утворюється між атомами цих елементів.
23. Обґрунтуйте, що є спільним і відмінним в електронній будові йона S2 та Ca2-.
24. Елемент головної підгрупи Vl групи утворює вищий оксид, відносна молекулярна маса якого становить 80. Встановіть елемент, запишіть формулу вищого оксиду, спрогнозуйте тип його кристалічної ґратки та фізичні властивості цієї речовини.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:54, Переглядів: 28278