Ковалентний зв'язок

Чому прості речовини теж сполуки?
У повітрі, яким ми дихаємо, містяться прості речовини: кисень O2, азот N2, інертний газ аргон Аг. Найпоширеніший елемент Всесвіту — Гідроген, утворює сполуку водень Н2 — джерело енергії для зірок. Крім того, хіміки знають багато інших сполук — простих речовин, молекули яких двохатомні. Дослідимо, чому молекули бувають одноатомні та двхоатомні. Як утворюються двохатомні молекули?
Пам’ятайте! Обґрунтуйте існування одноатомних молекул благородних газів, спираючись на будову електронних оболонок Їхніх атомів.
Нa відміну від атомів інертних газів, атоми інших елементів, зокрема й немегалічних, мають незавершені зовнішні енергетичні рівні. Усі електрони атомів інертних газів спарені, тому вони майже не утворюють сполук з атомами інших елементів, їхні молекули одноатомні.
Гілберт Ньютон Льюїс (мал. 36) 1916 року запропонував розглядати утворення зв’язку як наслідок виникнення спільних для двох атомів електронних нар.
Утворенні! молекул простих речовин
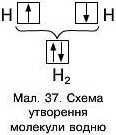
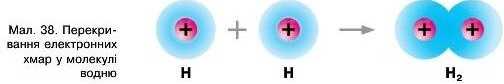
Молекули водню утворюються під час взаємодії атомів Гідрогену, які мають по одному валентному електрону Is3. Стійка електронна оболонка атома Гідрогену має складати 2 електрони, подібно до зовнішньої електронної конфігурації Гелію (мал. 37). Для цього кожний атом надає по одному s-електрону у спільне користування (мал. 38). Оскільки орбіталь s-електронів має вигляд хмари сферичної форми, у місці перекривання електронних хмар двох атомів на відрізку, що уявно з’єднує їхні ядра, утворюється більша електронна густина. Саме у цій області перебування електронів у молекулі найвірогідніше ця хмара «стягує» ядра. Таким чином утворюється хімічний зв’язок у молекулі водню.
Щоб візуалізувати утворення молекул використовують електронні формули, в яких позначають лише зовнішні електрони, щоб не нагромаджувати графічні позначки, крапочками з чотирьох боків від символу елемента. Спільні пари електронів розміщують між символами елементів.
Електронні формули речовин, що відображають суть хімічних зв’язків запропонував американський фізико-хімік Г Н. Льюїс. Іноді ці формули називають його ім’ям — формули Льюїса.
Схема утворення молекули водню:
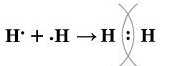
Якщо кожну спільну електронну пару зображати не крапочками, а рискою — така формула називається структурною. Для водню вона має вигляд:
H — Н.
Ковалентний — від лат. Ko — разом, valentia — сила.
Хімічний зв’язок у молекулі водню реалізується спільною електронною парою.
Це найпоширеніший тип зв’язку. Його називають ковалентним.
Ковалентний зв’язок — це зв’язок атомів за допомогою спільних електронних пар.
Розглянемо утворення двохатомної молекули кисню з огляду на будову атомів Оксигену.
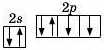
На зовнішньому енергетичному рівні атомів Оксигену міститься по 6 електронів.
Електронна конфігурація Оксигену ls22s22p4.
Графічна формула нони і пінного енергетичного ріння:
Оксиген має два неспарені електрони, тому кожен атом Оксигену, сполучаючись, віддає на утворення зв’язку по два неспарені електрони.
Електронна формула молекули кисню:
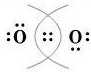
Молекула кисню, на відміну від молекули водню, утворена двома спільними електронними нарами. Структурна формула кисню: 0 = 0.
У молекулі водню зв’язок утворюється однією спільною парою і називається одинарний, а в молекулі кисню зв’язок подвійний. У молекулі азоту N2 зв’язок потрійний.
Утворення молекул складних речовин
Ковалентний зв’язок виникає не тільки між атомами однакових неметалічшіх елементів, але й між атомами різних неметалічних елементів.
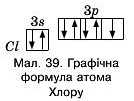
Наприклад, молекула гідроген хлориду утворюється за рахунок одного неспареного з-електрона атома Гідрогену та одного неспареного р-електрона атома Хлору, який має на зовнішньому енергетичному рівні сім електронів (мал. 39).
Перекривання орбіталей s-електрона атома Гідрогену та р-електрона атома Хлору приводить до утворення зв’язку (мал. 40).
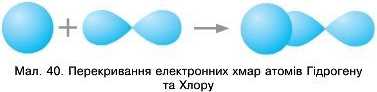
Схема утворення молекули гідроген хлориду:
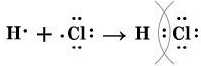
Електронна формула молекули гідроген хлориду:
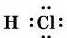
Структурна формула гідроген хлориду: H — СІ.
За рахунок утворення ковалентного зв’язку кожний атом отримує у спільне користування електронні пари та оточує себе октетом (від лат. octo — вісім) або дублетом електронів, подібно до зовнішньої електронної конфігурації інертних газів.
потрібне.
Я зрозумів (-ла), що ... . Було важко ... . Я дізнався (-лисп) про ... . Я зумів (-ла)... . Мене здивувало .... Було корисно ... . Тепер я умію ... . Я не зрозумів (-ла) ... .
1. Чому молекули інертних газів у вільному стані одноатомні?
2. За яких умов виникає хімічний зв’язок?
3. Яка природа хімічного зв’язку?
4. Як встановити кількість зовнішніх електронів?
5. Як утворюється ковалентний зв’язок?
6. Що є основною ознакою ковалентного зв'язку?
7. Виберіть формули речовин з ковалентним зв’язком: CuO1 Br2l КІ, Sh, Fe, Ne, O21 BaO1 H2S, NaCI1 P4, K3N, НІ.
8. Запишіть електронну конфігурацію електронної оболонки Флуору. Запишіть електронну та структурну формули двохатомної молекули фтору. Намалюйте перекривання електронних хмар. Спільна електронна густина має бути на відрізку, що умовно з'єднує ядра.
9. Запишіть електронну та структурну формули азоту.
10. Відносна молекулярна маса леткої сполуки з Гідрогеном елемента Vll групи становить 81. Знайдіть елемент. Запишіть електронну та структурну формулу цієї сполуки.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:48, Переглядів: 1854