Графічні та електронні формули атомів хімічних елементів
Продовжуємо занурення у мікросвіт. Які нравила ннм керують?
Саме для розуміння принципу періодичної зміни властивостей хімічних елементів зі збільшенням заряду ядер атомів ми вивчаємо будову їхніх електронних оболонок і способи її графічноіч) відображення.
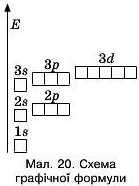
Будову електронної оболонки атома можна записати за допомогою графічної або електронної формули.
Графічна формула
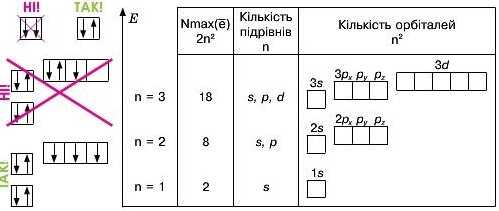
Для кращої уяви будь-яку орбіталь зображують квадратом — коміркою ET. Електрони у комірках позначають стрілками. На окремій орбіталі можуть бути максимум два електрони з протилежними спінами, тому в одній комірці їх зображують за допомогою протилежно напрямлених стрілок.
Кількість комірок чітко визначена та записується на певному рівні одна відносно іншої (мал. 20).
Пригадайте! Як визначити кількість енергетичних підрівнів, ор-біталей та максимальну кількість електронів на окремому енергетичному рівні?
А.-иоритм складання графічної формули атома на прикладі Нітрогену
1. Визначаємо номер періоду, у якому розташований елемент.
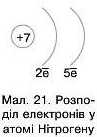
Нітроген знаходиться у 2 періоді, отже його електронна оболонка має 2 енергетичні рівні.
2. За протонним числом визначаємо загальну кількість електронів.
Протонне число Нітрогену — 7, отже на двох енергетичних рівнях розташовано 7 електронів.
3. Розраховуємо кількість електронів на енергетичних рівнях.
На першому енергетичному рівні (п = 1) потрібно розмістити 2 електрони, на другому — зовнішньому рівні: 7-2 = 5 електронів (мал. 21).
4. Креслимо комірки, що відображають орбіталі та заповнюємо їх електронами — у вигляді стрілочок.
Малюемо комірку для першої з-орбіталі першого енергетичного рівня нижче, ніж для S-та р-орбіталей другого енергетичного рівня.
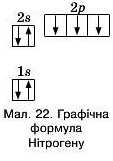
Кожен енергетичний рівень починається із заповнення електронами 8-підрівня, який е енергетично більш вигідним, ніж р-підрівень.
На першому енергетичному рівні атома Нітрогену розміщуємо два з-електрони, з п’яти електронів другого енергетичного рівня два мають бути з-електронами, а ще три — р-електрони (мал. 22).
Пам’ятайте!
• На кожному енергетичному рівні спочатку заповнюємо стрілочками комірки, що позначають s-орбіталь, далі — р-орбіталь і т. д.
• У комірці слід малювати спочатку по одній стрілочці. Коли комірки цього підрівня закінчуються, додаємо у кожну по другій стрілочці.
• Якщо на орбіталі розміщується лише один електрон — його називають неспареним, відповідно два електрони називають спареними.
Електронна формула
Для запису електронної формули використовують відомі вам позначення форм орбіталей електронів: з, р, іі. Перед кожною англійською літерою вказують номер енергетичного рівня, а за ними верхнім числовим індексом — кількість електронів на цій орбіталі. Наприклад, електронна формула Нітрогену:
ls22s22p3
Складаємо графічну та електронну формули Хлору
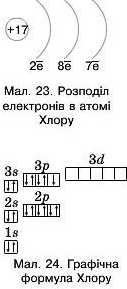
1. Хлор — елемент 3-го періоду, отже, має три енергетичні рівні; протонне число — 17, отже, атом має 17 електронів, які розміщуються на трьох рівнях (мал. 23).
2. Записуємо графічну формулу для атома Хлору. На першому енергетичному рівні розміщена одна
з-орбіталь, на другому — 2з та 2 р-орбіталі, на третьому — 3з, 3р та Зб/-орбіталі.
3. Заповнюємо їх електронами, кількість яких розраховано для кожного енергетичного рівня, крім зовнішнього, за формулою 2п2(мал. 24).
4. Записуємо електронну формулу Хлору:
ls22s22pe3s23pft.
Оскільки d-орбіталь атома Хлору не заповнена, у електронній формулі її можна не вказувати.
За електронною формулою атома можна також визначити сам елемент і його місце в періодичній системі. Наприклад, електронна формула атома: ls22s22pe3s23p3.
Знаходимо суму всіх верхніх числових індексів та отримуємо загальну кількість електронів в атомі цього елемента: 2 + 2 + 6 + 2 + 3=15. Оскільки кількість електронів збігається з нротонним числом, то цей елемент — Фосфор.
Доповніть схему правилами складання формул
у мікросвіті.
1. Що виражає графічна формула?
2. Як зображують електронну орбігаль та електрони у графічній формулі?
3. Чому в одній комірці електрони позначають різнонаправленими стрілками?
4. На що вказують цифри, англійські літери та верхні індекси у електронній формулі?
5. Встановіть відповідність між чисельними даними у періодичній системі та їхнім фізичним змістом.
А протонне число 1 кількість нейтронів
Б нуклонне число 2 кількість електронних шарів
В номер періоду 3 відносна атомна маса
4 заряд ядра
6. Виберіть ряди, у яких записані символи елементів тільки великих періодів періодичної системи.
A Be, Pt, Si, In Г Sc, Nb, Ag, Pb
Б Co, Sr, Os, Ba Д Н, Pd, Cd, В
В He, U1 С, As
7. Встановіть елементи за електронними формулами.
A 1sJ 2s?
Б 1s22s32p'
В 1s22s22p4 Г 1s22s22pfi3s'
8. Складіть графічні та електронні формули Карбону, Оксигену та Магнію.
9. Запишіть рівняння реакції взаємодії простих речовин, які мають наступні електронні формули атомів 1s22s?2p^s^p' та 1s22s22p4.
10. Визначте елемент за електронною формулою .. .4s2. Запишіть формули його оксиду та гідрату оксиду.
11. Знайдіть інформацію про значення елемента, встановленого у завданні 10, для організму людини.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:36, Переглядів: 79470