Ізотопи
Як нояснити, що вперіоднчній системі відносні атомні маси хімічних елементів дробові?
ІЗОТОПИ
Ізотопи — від грец.: ізос — однаковий, топос — місце, — ті елементи, що займають одне й те саме місце в періодичній системі.
7. Встановіть, послідовно чи періодично змінюються зазначені характеристики елементів.
1 періодично А нуклонне число
2 послідовно Б протонне число
В металічні властивості Г валентність за Оксигеном Д валентність за Гідрогеном
8. Основним джерелом цього важливого для людини елемента є тваринні продукти — м’ясо, риба, яєчний жовток, молочний сир, твердий сир. За дослідженнями вчених-медиків встановлено, що школярі, які люблять і щодня вживають молоко, краще навчаються. Встановіть цей елемент, якщо відомо, що він розміщений у V групі, головній підгрупі, а відносна молекулярна маса його вищого оксиду становить 142. Обчисліть кількість нейтронів у атомному ядрі цього елемента.
9. Елемент Vl групи головної підгрупи входить до складу білків та інших біомолекул. У кінці XIX ст. у Південно-Східній Азії сотні тисяч людей загинули від хвороби 6έρΐ-6έρϊ, причина якої — нестача цього елемента. Масоєа частка його у вищому оксиді складає 40 %, а відносна молекулярна маса цього оксиду становить 80. Встановіть елемент.
10. Підготуйте повідомлення про українського вченого Д. Д. Іваненка та його внесок у теорію будови атома.
Лише 20 елементів із періодичної системи мають нуклонне число, що майже збігається зі значенням їхньої відносної атомної маси. Для більшості елементів характерне існування в природі атомів з однаковими протонними і різними нуклонними числами. Такі атоми називаються ізотопами.
Ізотопи — це різновиди атомів одного елемента з однаковими протонними, але різними нуклонними числами.
Нуклід
Існуванням ізотонів пояснюють дробові значення відносних атомних мас елементів. Для атомів, що мають однакові нуклонні числа, використовують термін ну-
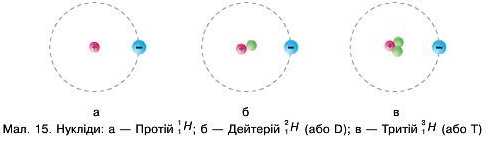
Найпоширенішим нуклідом Гідрогену є Протій (Н). На 6800 атомів Протію нараховується 1 атом Дейтерію (D). Тритій (T) — надважкий нуклід Гідрогену. Важка вода D2O використовується як уповільнювач нейтронів в ядерних реакторах. Виробництво 1 кг Тритію коштує приблизно ЗО млн доларів.
клід. Слід зауважити, що іменник нуклід вживають переважно в однині, а слово ізотопи — у множині.
Найпоширеніший у Всесвіті елемент Гідроген має три нукліди: Протій \Н, Дейтерій \Н (або D) та Тритій \Н (або Т) (мал. 15). Гідроген у природних сполуках — це переважно Протій. У наведених позначеннях нуклідів Гідрогену використано індекси: верхні — вказують на нуклонне число, а нижні — на протонне число (порядковий номер). Така форма запису використовується і для всіх інших елементів.
Більшість елементів періодичної системи має не тільки стабільні а й по кілька нестабільних радіоактивних ізотонів. Стабільних ізотопів відомо приблизно 300, а радіоактивних більше 2000. Усі атоми елементів з порядковим номером більшим за 83 — радіоактивні.
Пригадайте! На яку характеристику ядер атомів вказує нуклонне число? Як за допомогою періодичної системи визначають нуклонне число елементів? Чи можна ототожнювати поняття нуклонне число й відносна атомна маса? Чому?
Атомна частка χ (хі) — це відношення кількості атомів певного нукліда до загальної кількості атомів елемента.
Правильність розміщення в періодичній системі Калію та Аргону підтверджується існуванням ізотопів цих елементів: 3!>К, 40K, 41K, 3eAr, 3sAr, 40Ar. Обчислимо їхні відносні атомні маси з урахуванням атомної частки нуклідів у природі.
За аналогією проведіть обчислення для елемента Калію. Атомні частки його нуклідів становлять:
χ(Τ,Κ) = 93,08 %; X(T0K) = 0,01 %; χ(“Κ) = 6,91 %.
Встановіть заряди ядер атомів Калію та Аргону. Зробіть висновок про правильність чи неправильність їхнього розміщення у періодичній системі.
Отже, нуклонне число стосується певного нукліда, а відносна атомна маса — суміші нуклідів конкретного елемента.
Нукліди Аргону використовують як «мічені атоми» — радіоактивні індикатори в медицині та фармакології.
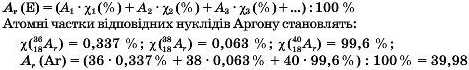
Хімічні властивості нуклідів однакові, саме тому хімічними способами їх розділити неможливо.
Якщо знати відносну атомну масу елемента та інформацію про нукліди цього елемента, можна встановити їхні атомні частки у природі.
Розв’яжемо задачу. Купрум має два нукліди ^Cu та ^Cu. Обчисліть атомні частки цих нуклідів у природі.
Розв’язування.

Відповідь: атомні частки нуклідів з нуклонними числами 63 і 65 відповідно становлять 72,5% та 27,5%.
Пам’ятайте! .Ar(Cl) = 35,5. Не округлюють до цілих!
Сучасне формулювання періодичного закону
Відкриття радіоактивних ізотопів було сприйняте як загроза для Періодичного закону, в основу якого покладено головну характеристику елемента — відносну атомну масу. Оскільки у результаті розпаду атомів та радіоактивних ізотопів утворювалися атоми інших елементів, з іншими протонними числами, отже, — з іншим зарядом ядра.
Ґрунтуючись на нових відомостях про будову атома та про існування ізотопів, можна дати сучасне формулювання Періодичного закону.
Властивості елементів, а також властивості їхніх сполук перебувають у періодичній залежності від заряду ядра атома елемента.
Закінчіть речення, вибравши 2-3, які вважаєте за
потрібне.
Я зрозумів (-ла), що ... . Було важко ... . Я дізнався (-лась) про ... . Я зумів (-ла) .... Мене здивувало ... . Було корисно ... . Тепер я умію .. . Я не зрозумів (-ла) ... .
питання та завдання
1. Яка особливість ізотопів сформувала їхню назву?
2. Чому сучасні науковці уточнили формулювання Періодичного закону?
3. Знайдіть у періодичній системі дві пари елементів (крім Аргону і Калію), які порушують порядок розміщення за збільшенням мас атомів.
4. Визначте кількість нейтронів у нуклідах Телуру.
IK7- IZS7- IMt &2ІЄ, 52,Є. 52/Є
5. Природний Магній міститься у хлорофілі, що забезпечує процес фотосинтезу. Магній має три нукліди. їхні атомні частки відповідно становлять:
X(T7Mg) = 78,6%; X(T2Mg) = 10,1%; X(T7Mg) = 11,3%.
Обчисліть відносну атомну масу Магнію з точністю до сотих.
6. Хлор має два нукліди 35C/ (у природі 75 %), 37C/. Обчисліть відносну атомну масу елемента Хлору.
7. Сплав бор-карбон-силіцій має надвисоку твердість й абразивні властивості та поступається за цими характеристиками лише алмазу. Природний Бор складається з двох нуклідів з нуклонними числами 10 і 11. Обчисліть атомні частки цих нуклідів.
8. В оксиді п'ятивалентного елемента його масова частка складає 43,67 %. Назвіть цей елемент і визначте склад його атома.
9. Знайдіть інформацію про використання радіоактивних нуклідів у медицині.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:35, Переглядів: 2093