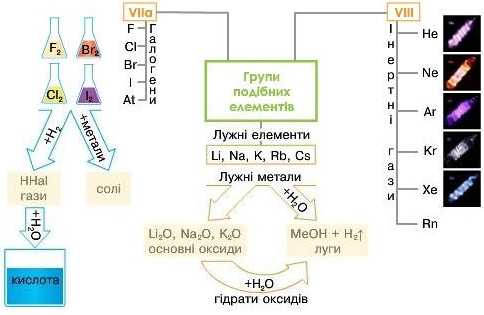
Поняття про групи подібних елементів
За якими властивостями елементи об’єднують у труїш?
За аналогією з иростнми речовинами, елементи по-діляють на металічні та неметал Ічні. Проте поділ цей умовний, OCKLibKu хімічний елемент Станум, порядковий номер 50, утворює дві прості речовини — сіре олово з неметалічними властивостями та біле олово, що виявляє металічні властивості. Елемент Карбон утворює просту речовину — алмаз, що не проводить електричний струм і графіт, якому, подібно металам, властива електропровідність.
З іншого боку, існують менш чисельні групи металічних і неметалічних елементів, сполуки яких дуже схожі за хімічними властивостями.
Лужні метали
Розглянемо групу лужних елементів: Літій, Натрій, Калій, Рубідій і Цезій. Прості речовини цих елементів є дуже активними металами, сріблясто-білого кольору, які м’які настільки, що їх можна різати скальпелем (мал. 7). Ці метали активно реагують з киснем повітря, тому їх зберігають під шаром гасу (мал. 8). Літій, через малу густину, навіть спливає на поверхню гасу, тому його зберігають переважно у запаяних ампулах.
У процесі окиснення киснем літій утворює оксид Li2O, інші лужні метали — пероксиди: Na2O2, KO2, про які ви дізнаєтесь пізніше.


Взаємодіючи з водою, усі ці метали утворюють луги MeOII, тому й прості речовини, й елементи мають назву: лужні (мал. 9).
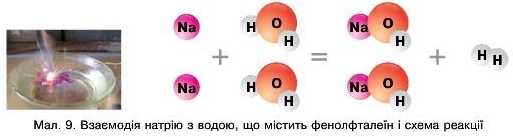
Проаналізуйте малюнок та перетворіть схему реакції на рівняння.

Галогени — з грец. — ті, що утворюють солі.

Калій — активніший метал порівняно з натрієм та літієм. Взаємодія калію з водою відбувається з вибухом; а літій не вибухає.
Галогени
Серед типових неметалічних елементів властивостями простих речовин яскраво вирізняються галогени Hal: Флуор, Хлор, Бром і Йод (мал. 10).
Ці елементи утворюють прості речовини, молекули яких двохатомні, різні за агрегатним станом, відмінні за запахом і кольором. Фтор F2 — газ з різким запахом жовтуватого кольору. Хлор Cl2— газ з різким подразнюючим запахом жовто-зеленого кольору. Бром Br2 — буро-коричнева рідина з різким запахом. Йод I2 — чорно-фіолетові кристали з металічним блиском. Проте бром та йод (за нагрівання) — леткі.
Хімічні властивості цих речовин дуже подібні. Фтор за звичайних умов взаємодіє з металами, навіть золото і платина під час нагрівання згоряють в атмосфері фтору. Інші галогени під час нагрівання також реагують з металами, у результаті утворюються солі. З воднем ці речовини утворюють бінарні сполуки HF, НС1, IIBr, НІ, які добре розчиняються у воді й утворюють кислоти.
Інертні гази
Цікавою і незвичайною труною елементів, що утворюють прості речовини, вважають інертні, або благородні, гази.
Пригадайте! Які «благородні» метали вам відомі? Чому їх так
називають?
Спочатку Гелій Небув відкритий через дослідження спектрів Сонця 1868 року. Від латинської назви Сонця його й назвали «Сонячний газ». Лише через ЗО років його знайшли на Землі.
Через хімічну пасивність гелію, неону, аргону, криптону, ксенону та радону ці елементи були відкриті наприкінці XIX століття англійцем Вільямом Рамзаем.
Майже за 50 років до їхнього відкриття Д. Менделєєв нередбачив існування цих елементів. Вони утворюють невелику кількість сполук з іншими елементами за дуже жорстких умов. Лише у XX столітті були добуті сполуки Ксенону з галогенами та Оксигеном.
Молекули простих речовин інертних елементів одноатомні: He, Ne, Ar, Xe, Kr, Rn.
Охарактеризуйте групи подібних елементів за інтелект-ка ртою.
1. Перелічіть лужні метали. Опишіть їхні фізичні властивості.
2. Через яку властивість лужні метали мають таку назву?
3. Порівняйте властивості галогенів та інертних газів.
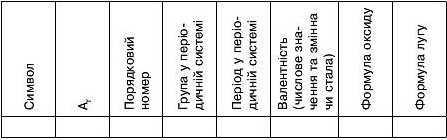
4. Складіть за зразком узагальнювальну таблицю характеристик елементів і сполук лужних елементів, розміщуючи їх у порядку збільшення відносної атомної маси.
5. У сучасній атомній енергетиці літій використовують як теплоносій в реакторах, у космічній галузі — як добавку до ракетного пального. Літій оксид використовують під час виробництва спеціального скла та термостійких покриттів. Обчисліть масову частку Літію у літій оксиді.
6. Обчисліть масову частку розчиненої речовини у розчині кислоти, що утворився під час розчинення гідроген хлориду HCI масою 20 г у воді масою 60 г.
7. Розгляньте малюнок "Взаємодія натрію з водою». У кристалізатор з водою додано індикатор — фенолфталеїн. Поясніть причину появи малинового кольору розчину.
8. Знайдіть цікаву інформацію про хімічний елемент Астат. Спрогнозуй-те властивості сполук Астату, скористайтесь для цього періодичною системою.
9. Радон (англ, radon) — радіоактивний хімічний елемент Vlll групи періодичної системи. Знайдіть інформацію про використання радону
з лікувальною метою в Україні.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:26, Переглядів: 2154