Хімічні властивості амфотерних гідроксидів
Після опрацювання параграфа ви зможете:
• наводити прикладиамфотерних гідроксидів, складатиформули цих сполук і розрізнятиїх;
• характеризуватифізичні та хімічні властивості амфотерних гідроксидів і складати відповідні рівняння реакцій;
• обґрунтовуватизалежність між властивостями та застосуванням амфотерних гідроксидів, оцінюватиїхнє значення.
Амфотерністю, як вам уже відомо, називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості (рис. 32.1). Наприклад, з кислотами гідроксиди Алюмінію та Цинку реагують як основи, з лугами - як кислоти.

Приклади деяких амфотерних гідроксидів наведено в таблиці 32.1.
Таблиця 32.1
Амфотерні гідроксиди
|
Амфотерний гідроксид |
Кислотний залишок і його валентність |
|
|
основна форма |
кислотна форма |
|
|
Zn(OH)2 |
H2ZnO2 |
ZnO2 (II) |
|
Al(OH)3 |
HAlO2 (H3AlO3 - H2O = HAlO2) |
AlO2 (I) |
|
Be(OH)2 |
H2BeO2 |
BeO2 (II) |
|
Sn(OH)2 |
H2SnO2 |
SnO2 (II) |
|
Pb(OH)2 |
H2PbO2 |
PbO2 (II) |
|
Fe(OH)3 |
HFeO2 (H3FeO3 - H2O = HFeO2) |
FeO2 (I) |
|
Cr(OH)3 |
HCrO2 (H3CrO3 - H2O = HCrO2) |
CrO2 (I) |
У природі амфотерні гідроксиди трапляються досить рідко. Цинк гідроксид - складник мінералу ашовериту. Алюміній гідроксид входить до складу мінералу гіббситу (рис. 32.2).

Звичайно, здобуту інформацію потрібно перевірити експериментально. Для цього добудемо цинк гідроксид реакцією обміну в розчині між цинк нітратом і натрій гідроксидом:

Зверніть увагу: ми поступово добавлятимемо натрій гідроксид до розчину солі Цинку. Добутий білий драглистий осад цинк гідроксиду розділимо на дві рівні порції. На одну порцію осаду подіємо хлоридною кисло-
тою, на іншу - розчином натрій гідроксиду. В обох випадках осад розчиняється:
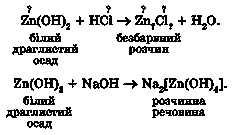
Зверніть увагу: унаслідок взаємодії цинк гідроксиду з лугом у розчині утворюється розчинна речовина складної будови - натрій тетрагідроксо-цинкат. Префікс тетра- означає чотири - у цій складній речовині чотири гідроксильні групи. Складний аніон у формулі цієї солі ми відокремлюємо квадратними дужками.
Аналогічно реагує з кислотами та лугами алюміній гідроксид:
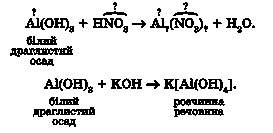
Спрощено записати рівняння реакцій гідроксидів цинку й алюмінію з лугами можна так:
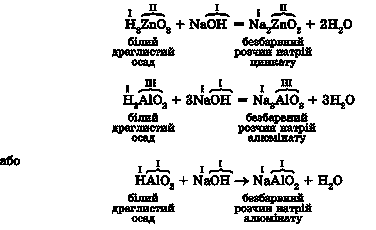
Зверніть увагу: у формулах амфотерних гідроксидів символи атомів Гідрогену записані першими - як у формулах кислот.
Замініть кожний двовалентний атом Оксигену у складі кислотних залишків -цинкату й алюмінату - на відповідне число одновалентних гідроксильних груп. Наприклад, один двовалентний атом Оксигену потрібно замінити двома одновалентними гідроксильними групами. Порівняйте одержані хімічні формули з наведеними в тексті параграфа.
Перетворіть схеми хімічних реакцій, які характеризують добування та амфотерні властивості цинк гідроксиду й алюміній гідроксиду, на хімічні рівняння. Запишіть рівняння реакцій, які характеризують хімічні властивості: а) берилій гідроксиду; б) хром(Ш) гідроксиду. Складіть хімічні формули відповідних амфотерних оксидів.
Застосування амфотерних гідроксидів зумовлене їхніми властивостями. Наприклад, алюміній гідроксид входить до складу антацидних лікарських засобів «Маалокс», «Алмагель» тощо. (Поміркуйте й поясніть, кислотні чи основні властивості алюміній гідроксиду зумовили його застосування як засобу проти печії).
Хром(ІН) гідроксид застосовують для виготовлення хром(ІІІ) оксиду -полірувального засобу. Також він - компонент пігментів тіней для повік, мила (рис. 32.3).

Рис. 32.3. Хром(ІІІ) гідроксид - складник тіней для повік. Завдання. Поміркуйте й назвіть ті властивості хром(ІІІ) гідроксиду, які, на вашу думку, зумовили його застосування як пігменту у складі декоративної косметики
Цинк гідроксид використовують для синтезу різноманітних сполук Цинку. Продукт взаємодії цинк гідроксиду з калій гідроксидом застосовують як білі чорнила для створення написів на чорній поверхні металів. Після висушування на металі залишаються білі літери. (Запишіть хімічну формулу сполуки - продукту реакції цинк гідроксиду з калій гідроксидом - та рівняння відповідної хімічної реакції).
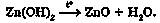
Розкладання за нагрівання - властивість, притаманна амфотерним гідроксидам, як і будь-якій нерозчинній основі. Наприклад, цинк гідроксид, який осаджують зі стічних вод металургійних комбінатів, є сировиною для добування цинк оксиду, на основі якого виробляють цинкове білило:
Алюміній гідроксид використовують як нетоксичну вогнезахисну неорганічну добавку до полімерних матеріалів. Під час термічного розкладання алюміній гідроксиду утворюється водяна пара. Унаслідок цього виникає паровий бар’єр на шляху надходження кисню до зони горіння і відведення продуктів горіння. (Складіть рівняння реакції термічного розкладання алюміній гідроксиду).
ПРО ГОЛОВНЕ
• Амфотерністю називають здатність деяких хімічних сполук, наприклад гідроксидів, залежно від умов виявляти або основні, або кислотні властивості.
• Амфотерними є г ідроксиди Цинку, Берилію, Плюмбуму(ІІ), Стануму(ІІ), Хрому(ІП), Титану(ІУ) тощо.
• Амфотерні властивості виявляють купрум(ІІ) гідроксид і ферум(ІІІ) гідроксид. Проте в цих гідроксидів кислотні властивості виражені значно слабше, ніж основні.
• Застосування амфотерних гідроксидів зумовлене їхніми властивостями.
Перевірте себе
1. Що таке амфотерність? 2. Гідроксиди яких хімічних елементів є амфотерними?
3. Чи трапляються амфотерні гідроксиди у природі? 4. Де застосовують амфотерні гідроксиди?
Застосуйте свої знання й уміння
1. Наведіть приклади амфотерних гідроксидів. Поясніть, гідроксиди яких елементів - металічних чи неметалічних - є амфотерними.
2. Пригадайте, які гідроксиди входять до складу антацидного препарату «Маалокс». Складіть рівняння хімічних реакцій за участю гідроксидів, які відбуваються внаслідок змішування цього препарату з розчинами: а) нітратної кислоти; б) калій гідроксиду.
3. Зазвичай стічні води очищують від розчинних солей Алюмінію, Цинку та Хрому(Ш), обробляючи їх лугом, наприклад натрій гідроксидом. Поясніть, чому надлишок лугу зменшує ефективність очищення. Відповідь підтвердите рівняннями хімічних реакцій.
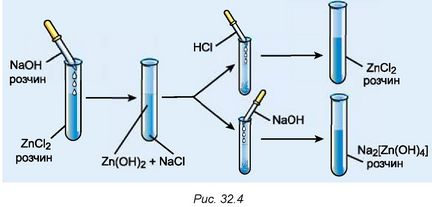
4. За рисунком 32.4 опишіть хід досліду й спостереження під час добування нерозчинного гідроксиду й доведення його амфотерності.
5. Обчисліть масу (г) цинк хлориду, який можна добути із цинк гідроксиду кількістю речовини 8 моль.
6. Обчисліть максимальну масу (кг) хром(Ш) гідроксиду, який можна осадити зі стічних вод натрій гідроксидом масою 4 кг.
7*. Одна таблетка препарату «Маалокс» містить алюміній гідроксид масою 400 мг та магній гідроксид масою 400 мг. Обчисліть масу (г) гідроген хлориду, розчиненого у шлунковому соку, який витратиться на повну нейтралізацію амфотерного гідроксиду, що міститься в 10 таблетках препарату.
Творча майстерня
Сплануйте дослідження нейтралізувальної дії тих антацидних засобів, які містять амфотерний гідроксид. Обговоріть план дослідження з учителем, порадьтеся з батьками, приятелями. Для проведення дослідів використайте рослинні індикатори, столовий оцет, натуральний шлунковий сік*, ацидин-пепсин* (*це аптечні препарати, зокрема, 1 таблетка ацидин-пепсину масою 0,25 г замінює 16 крапель розбавленої хлоридної кислоти). Підготуйте презентацію здобутих результатів.
Дізнайтеся більше:
http://files.school-collection.edu.ru/dlrstore/0aba9f22-4185-1 1db-b0de-0800200c9a66/x9_167.swf
https://www.youtube.com/watch?v=64P2B4loGsM
https://www.youtube.com/watch?v=aPdKbax2de0
Практична робота 1
ДОСЛІДЖЕННЯ ВЛАСТИВОСТЕЙ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК
Під час виконання цієї роботи ви застосуєте набуті знання про властивості класів неорганічних сполук та взаємозв’язки між ними, удосконалите вміння складати план експерименту й проводити його, робити висновки, працювати за інструкцією й розв’язувати експериментальні задачі.
За потреби використайте таблицю розчинності основ, кислот, амфотерних гідроксидів і солей у воді.
Увага! Для кращого спостереження використовуйте контрастний екран. Якщо досліди виконуєте у пробірках, беріть по 5 крапель розчинів реагентів.
Якщо дослід виконуєте в заглибинах пластини, то досить узяти по 2—3 краплі розчинів реагуючих речовин.
Будьте особливо обережні під час роботи з їдкими й отруйними речовинами, нагрівальними приладами та скляним хімічним посудом!

Вам видано штатив з пробірками або пластину для крапельного аналізу, скляні палички, піпетки, чорно-білий екран; розчини лугів, кислот, солей, нагрівальний прилад, тримач для пробірок тощо.
Виконайте досліди за порадою вчителя, використовуючи наявні реактиви.
Варіант 1.1
Реактиви: хлоридна кислота; залізо (сталевий виріб); розчини натрій гідроксиду, барій хлориду, купрум(ІІ) сульфату, лакмусу.
1. У три пробірки (або заглибини пластини для крапельного аналізу) помістіть хлоридну кислоту, розчини натрій гідроксиду, барій хлориду. До кожної з відібраних проб речовин добавте розчин лакмусу. Опишіть спостереження й поясніть їх.
2. До проби розчину натрій гідроксиду, підфарбованого лакмусом (див. дослід 1) піпеткою по краплях добавляйте хлоридну кислоту, перемішуючи реакційну суміш скляною паличкою. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
3. У розчин купрум(ІІ) сульфату обережно занурте сталевий виріб. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
4. До розчину купрум(ІІ) сульфату добавте розчин барій хлориду. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
5. До розчину купрум(ІІ) сульфату добавте розчин натрій гідроксиду. Трохи осаду, що утворився, помістіть на скельце й, використовуючи про-біркотримач, обережно нагрійте. Опишіть спостереження й поясніть їх. Складіть відповідні хімічні рівняння.
Варіант 1.2
Реактиви: залізо (сталевий виріб); розчини сульфатної кислоти, калій гідроксиду, калій сульфату, купрум(ІІ) хлориду, барій нітрату, метилового оранжевого.
1. У три пробірки (або заглибини пластини для крапельного аналізу) помістіть розчини сульфатної кислоти, калій гідроксиду та калій сульфату. До кожної з відібраних проб речовин добавте розчин метилового оранжевого. Опишіть спостереження й поясніть їх.
2. До проби розчину сульфатної кислоти, підфарбованого метиловим оранжевим (див. дослід 1) піпеткою по краплях добавляйте розчин калій гідроксиду, перемішуючи реакційну суміш скляною паличкою. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
3. У розчин сульфатної кислоти обережно занурте сталевий виріб. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
4. До розчину калій сульфату добавте розчин барій нітрату. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
5. До розчину купрум(ІІ) хлориду добавте розчин калій гідроксиду. До осаду, що утворився, добавте розчин сульфатної кислоти, перемішуючи реакційну суміш скляною паличкою. Опишіть спостереження й поясніть їх. Складіть відповідні хімічні рівняння.
Варіант 1.3
Реактиви: хлоридна кислота; розчини калій гідроксиду, аргентум(І) нітрату, калій хлориду, натрій карбонату, цинк сульфату; універсальний індикаторний папір.
1. На смужки універсального індикаторного паперу нанесіть за допомогою піпеток або скляних паличок хлоридну кислоту й розчини калій гідроксиду та калій хлориду. Опишіть спостереження й поясніть їх.
2. Помістіть поруч на смужку універсального індикаторного паперу по одній краплі хлоридної кислоти й розчину калій гідроксиду так, щоб, просочивши папір, реагенти змішалися. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
3. До розчину натрій карбонату добавте хлоридну кислоту. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
4. До розчину калій хлориду добавте розчин аргентум(І) нітрату. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
5. До розчину цинк сульфату обережно по краплях добавте розчин калій гідроксиду. До осаду, що утворився, добавте хлоридну кислоту, перемішуючи реакційну суміш скляною паличкою. Опишіть спостереження й поясніть їх. Складіть відповідні хімічні рівняння.
Варіант 1.4
Реактиви: розчини сульфатної кислоти, барій нітрату, калій гідроксиду, цинк хлориду; магній карбонат, універсальний індикаторний папір.
1. У три пробірки (або заглибини пластини для крапельного аналізу) помістіть розчини сульфатної кислоти, калій гідроксиду та барій нітрату. До кожної з відібраних проб речовин добавте розчин фенолфталеїну. Опишіть спостереження й поясніть їх.
2. До проби розчину калій гідроксиду, підфарбованого фенолфталеїном (див. дослід 1), піпеткою по краплях добавляйте розчин сульфатної кислоти, перемішуючи реакційну суміш скляною паличкою. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
3. До розчину сульфатної кислоти добавте розчин барій нітрату. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
4. До магній карбонату добавте розчин сульфатної кислоти. Опишіть спостереження й поясніть їх. Складіть відповідне хімічне рівняння.
5. До розчину цинк хлориду обережно по краплях добавте розчин калій гідроксиду. До осаду, що утворився, добавте розчин сульфатної кислоти, перемішуючи реакційну суміш скляною паличкою. Опишіть спостереження й поясніть їх. Складіть відповідні хімічні рівняння.
Варіант 2.1
Реактиви: хлоридна кислота; розчини калій гідроксиду, аргентум(І) нітрату, калій хлориду, натрій карбонату, цинк сульфату; універсальний індикаторний папір.
1. Дослідіть дію хлоридної кислоти, розчинів калій гідроксиду та калій хлориду на універсальний індикаторний папір.
2. Здійсніть реакцію нейтралізації.
3. Добудьте карбон(ІУ) оксид.
4. Добудьте унаслідок одного перетворення нерозчинний хлорид та розчинний нітрат.
5. Добудьте амфотерний гідроксид, а з нього - розчинний хлорид.
Варіант 2.2
Реактиви: розчини сульфатної кислоти, барій нітрату, калій гідроксиду, калій нітрату, цинк хлориду; магній карбонат, універсальний індикаторний папір.
1. Дослідіть дію на фенолфталеїн розчинів сульфатної кислоти, калій гідроксиду, калій нітрату.
2. Здійсніть реакцію нейтралізації.
3. Добудьте нерозчинний сульфат.
4. Добудьте внаслідок одного перетворення розчинний сульфат і газу-ватий оксид.
5. Добудьте амфотерний гідроксид, а з нього - розчинний сульфат. Варіант 2.3
Реактиви: хлоридна кислота; залізо; розчини натрій гідроксиду, барій хлориду, купрум(ІІ) сульфату, лакмусу.
1. Дослідіть дію хлоридної кислоти, натрій гідроксиду та барій хлориду на лакмус у розчині.
2. Здійсніть реакцію нейтралізації.
3. Добудьте мідь.
4. Добудьте внаслідок одного перетворення нерозчинний сульфат та розчинний хлорид.
5. Добудьте нерозчинний гідроксид, а з нього - оксид.
Варіант 2.4
Реактиви: залізо (сталевий виріб); розчини сульфатної кислоти, калій гідроксиду, калій сульфату, купрум(ІІ) хлориду, барій нітрату, метилового оранжевого.
1. Дослідіть дію розчинів сульфатної кислоти, калій гідроксиду, калій сульфату на метиловий оранжевий.
2. Здійсніть реакцію нейтралізації.
3. Добудьте водень.
4. Добудьте внаслідок одного перетворення нерозчинний сульфат та розчинний нітрат.
5. Добудьте нерозчинний гідроксид, а з нього - розчинний сульфат.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:18, Переглядів: 4168