Оксиди
Після опрацювання параграфа ви зможете:
• називати оксиди за сучасною науковою українською номенклатурою;
• складати хімічні формули оксидів;
• описати поширеність оксидів у природі;
• характеризувати фізичні властивості оксидів та заходи безпеки під час роботи з ними, уплив на довкілля і здоров'я людини.
Оксиди, їхній склад, назви. Вивчивши в 7 класі хімічні властивості кисню, ви дізналися, що продуктами реакцій горіння вуглецю, сірки, фосфору, магнію є оксиди відповідних хімічних елементів.
За наведеними фрагментами відтворіть рівняння реакцій горіння, визначте ступені окиснення й валентність хімічних елементів в оксидах:
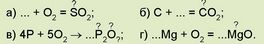
Усі продукти розглянутих реакцій сполучення - бінарні сполуки, до складу яких уходить Оксиген. Такі сполуки називають оксидами.
Оксиди — складні речовини, утворені двома елементами, одним з яких є Оксиген у ступені окиснення —2.
+2 -2 +6 -2
Наприклад, кальцій оксид CaO, сульфур(УІ) оксид SO3.
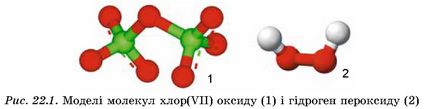
Зверніть увагу: в оксидах немає зв’язків між атомами Оксигену (рис. 22.1).
Виконуючи завдання, ви, безперечно, правильно визначили ступені окиснення і валентність хімічних елементів в оксидах. Тож легко зможете назвати ці сполуки за сучасною українською хімічною номенклатурою:
+4 +4 +5
SO2 - сульфур(ІУ) оксид; CO2 - карбон(ІУ) оксид; P2O5- фосфор(У) оксид; MgO - магній оксид. Називаючи магній оксид, валентність не зазначатимемо, адже валентність Магнію стала і дорівнює двом.
Узагальнимо, як ви це зробили: поруч із систематичною назвою атома електропозитивного елемента-катіона зазначили в дужках римською цифрою його ступінь окиснення і добавили назву оксиген-аніона - оксид. Наприклад, Cr2O3 - хром(ІІІ) оксид - вимовляємо хром-три-оксид.
Оксиди, у яких елементи виявляють свою найбільшу валентність, називають вищими оксидами. Загальні формули вищих оксидів наведено в періодичній системі під відповідними групами хімічних елементів. Наприклад, загальна формула вищого оксиду елементів IV групи EO2. Отже, хімічні формули вищих оксидів Карбону та Силіцію - CO2 і SiO2 відповідно.
Зверніть увагу: символ Оксигену в хімічних формулах оксидів записують другим. Назви оксидів є загальними, а не власними, тож їх пишуть з малої літери.
Поширеність оксидів, їхні фізичні властивості. Оксиди - досить поширені сполуки. Роздивімося - навколо нас є багато оксидів, які за звичайних умов перебувають у різних агрегатних станах і мають різне забарвлення. Оксиди металічних елементів є, переважно, йонними речовинами. Оксиди неметалічних елементів - молекулярні сполуки. У силі-цій(^) оксиду атомні кристалічні ґратки. Саме тому більшість оксидів металічних елементів за звичайних умов - тверді речовини (Ag2O, HgO, NiO, CuO). Манган^ІІ) оксид - рідина. Натомість багато які з оксидів


неметалічних елементів - газуваті (CO2, SO2, деякі з оксидів Нітрогену). Є рідкі оксиди. Це, передусім, вода (рис. 22.2), хлор^ІІ) оксид. Тверді оксиди неметалічних елементів - фосфор^) оксид,
силіцій(^) оксид, сульфур^І) оксид.
Чимало мінералів і руд є оксидами. Головним складником гематиту (червоного залізняку) є ферум(ІІІ) оксид. Він є компонентом фарб - вохри, сурику, мумії (рис. 22.3).
Палеолітичні наскальні малюнки бізонів, турів та оленів розмальовувалися вохрою.
Магній оксид - палена магнезія, легкий пухкий білий порошок -компонент лікарських засобів. Також до складу лікарських і косметичних засобів входять титан(ІУ) оксид і цинк оксид. Ці оксиди - тверді речовини білого кольору, нерозчинні у воді, нетоксичні. Тому їх застосовують для виготовлення косметичних кремів, мазей, пудри, дитячої присипки.
Білу тверду речовину - кальцій оксид (негашене вапно) - широко використовують у складі будівельних сумішей і в’яжучих розчинів. І наждак, і коштовні рубін та сапфір складаються переважно з алюміній оксиду (рис. 22.4). Як і багато інших оксидів металічних елементів, цей оксид є ефективним каталізатором.
Кварц - силіцій(ІУ) оксид - не лише входить до складу піску, а й утворює досить великі кристали, наприклад, гірського кришталю (рис. 22.5). Силіцій(ІУ) оксид - важлива сировина для виробництва будівельних матеріалів, кераміки, скла тощо.

Хром(ІІІ) оксид - тверда речовина темно-зеленого кольору - входить до складу полірувальної пасти та зеленої олійної фарби. Фарби, які використовують для оздоблення полив’яного посуду, містять тверді пігменти, поміж яких чимало оксидів. Наприклад, кобальт(ІП) оксид надає поливі синього й блакитного кольорів, нікель(ІН) оксид - коричневого та фіолетового, ферум(ІІІ) оксид - жовтого, червоного та коричневого, купрум(ІІ) оксид - зеленого та синьо-зеленого. Манган(ІУ) оксид забарвлює поливу в коричневий, фіолетовий та рожевий кольори. А уран(УІ) оксид та титан(ІУ) оксид надають їй відтінків жовтого (рис. 22.6).
Карбон(ІУ) оксид - добре відомий вам вуглекислий газ. Він міститься у продуктах газообміну, які утворюються під час дихання живих організмів, без нього неможливий процес фотосинтезу. Ним газують мінеральну

воду й напої, застосовують у виробництві соди та під час гасіння пожеж. Вуглекислий газ у твердому агрегатному стані - так званий сухий лід -використовують як охолоджувач.
Карбон(ІІ) оксид - чадний газ - є продуктом неповного згоряння палива. Він міститься у вихлопних газах автомобілів та тютюновому димі. У харчовій промисловості чадний газ використовують для оброблення м’яса тварин і риби - він надає їм, не змінюючи смаку продуктів, яскраво-червоного кольору й свіжого вигляду.
Газуватий сульфур(ІУ) оксид - засіб боротьби з мікроскопічними грибами і бактеріями в льохах. І він, і сульфур(УІ) оксид - проміжні продукти у виробництві сульфатної кислоти - «хліба» хімічної промисловості.
Нітроген(І) оксид, так званий звеселяючий газ, використовують як знеболювальний засіб у медицині та розпушувач у харчовій промисловості.
Оксиди є найпоширенішими сполуками на Землі: до цього класу належать вода, пісок, вуглекислий газ, алюміній оксид та ферум(Ш) оксид.
Глобальні екологічні проблеми, пов’язані з оксидами, заслуговують на особливу увагу. Є вагомі підстави вважати, що карбон(ІУ) оксид - одна з причин виникнення парникового ефекту на планеті Земля. Також разом з оксидами Сульфуру та Нітрогену(ІУ) вуглекислий газ зумовлює виникнення кислотних опадів (рис. 22.7). Пригадайте, ви вже дещо знаєте про них з курсу хімії 7 класу. Докладніше про ці явища та їхню хімічну природу ви дізнаєтеся з наступних параграфів.
Силіцій(ІУ) оксид спричиняє важке легеневе захворювання - силікоз. Пилові бурі, так само як повені, - небезпечні природні явища. Вони є справжнім екологічним лихом та завдають великих матеріальних збитків (рис. 22.8).


Небезпечними для здоров’я є отруйні карбон(ІІ) оксид (чадний газ), меркурій(Н) оксид, плюмбум(ІУ) оксид та чимало інших. Ось чому, щоб ефективно й безпечно використовувати оксиди, дуже важливо знати їхні фізичні й хімічні властивості та вплив на здоров’я людини і довкілля.
ПРО ГОЛОВНЕ
• Оксиди - складні речовини, утворені двома елементами, одним з яких є Оксиген.
• Ступінь окиснення Оксигену в оксидах завжди -2.
• Символ Оксигену в хімічних формулах оксидів записують другим.
• Називаючи оксид за його хімічною формулою, записують назву хімічного елемента, у дужках - значення валентності елемента в оксиді (для елементів зі змінною валентністю) і слово оксид.
• Оксиди досить поширені у природі, їх застосовують у промисловості й повсякденному житті.
• Щоб ефективно й безпечно використовувати оксиди, дуже важливо знати їхні властивості та фізіологічну дію.
Перевірте себе
1. Які речовини називають оксидами? 2. Який ступінь окиснення Оксигену в оксидах? 3. Чи сполучені атоми Оксигену в оксидах між собою? 4. Як називають оксиди за сучасною науковою українською хімічною номенклатурою? 5. Які оксиди називають вищими?
Застосуйте свої знання й уміння
1. Виберіть з переліку хімічні формули оксидів і назвіть їх за сучасною науковою українською хімічною номенклатурою: N2O3; CaCO3; H2SO4; Cu2O; Ag2O; N2O5; CrO3; COCl2; NaOH; CaCO3; Na2O2; O3; H2S; OF2.
2. Складіть хімічні формули оксидів за їхніми назвами: калій оксид, барій оксид, аурум(Ш) оксид; станум(^) оксид; арсен(Ш) оксид; арсену оксид; вольфрам^!) оксид.
3. Проаналізуйте хімічні формули оксидів, наведені в тексті параграфа і завданнях до нього. Користуючися періодичною системою, визначте, які з них відповідають вищим оксидам.
4. Опишіть поширеність оксидів.
5. Складіть схему «Поширеність оксидів в оболонках Землі». Зазначте хімічні формули оксидів (див. рубрику «Цікаво і пізнавально»), уміст яких у кожній оболонці найбільший.
6. Схарактеризуйте фізичні властивості кількох (на власний вибір) оксидів.
7. За наведеною інформацією визначте, про які оксиди йдеться, запишіть їхні хімічні формули й назвіть за сучасною українською хімічною номенклатурою: а) утворюється під час згоряння сірникової головки; б) поглинається акваріумними рослинами під час фотосинтезу; в) міститься в цинковому білилі (біла олійна фарба).
8. Проаналізуйте наведені в параграфі відомості про оксиди й узагальніть їх у формі таблиці (назва оксиду, хімічна формула, агрегатний стан за звичайних умов, колір).
9. Поясніть, чому під час шліфування кристалів кварцу робітники мають надягати захисні окуляри й респіратори.
10. Визначте й порівняйте масові частки Оксигену в: а) фосфор(Ш) оксиді й фосфор^ оксиді; б) ферум(ІІ) оксиді і ферум(Ш) оксиді.
11. Обчисліть масу кристалу кварцу, кількість речовини силіцій(^ оксиду в якому становить 0,5 моль.
12. У порції шліфувальної пасти масою 100 г міститься хром(Ш) оксид масою 60 г. Обчисліть кількість речовини (моль) хром(Ш) оксиду в порції цієї пасти масою 200 г.
13. Гранично припустимий уміст карбон(ІІ) оксиду в повітрі промислових підприємств становить 0,00002 г/л. Обчисліть гранично припустиме число молекул цього газу в цеху, об'єм повітря в якому становить 1000000 м3.
14. *«Нарзан» - всесвітньо відоме джерело мінеральної води (курорт Кисловодськ). Щодоби це джерело дає близько двох з половиною мільйонів літрів мінеральної води, яка містить вуглекислий газ масою до 5 т. Обчисліть об’єм (м3) цієї порції газу (н. у.).
Творча майстерня
1. Проаналізуйте зміст етикеток товарів повсякденного вжитку, побутової хімії, лікарських препаратів. Знайдіть на етикетках та в інструкціях з використання товарів відомості про оксиди й підготуйте презентацію «Оксиди в дії».
2. Дізнайтеся, використовуючи різноманітні джерела інформації, які Е числа відповідають оксидам у складі харчових продуктів. Зберіть відомості про властивості й фізіологічну дію цих оксидів. Підготуйте проект «Що ми їмо».
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:10, Переглядів: 2247