Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Після опрацювання параграфа ви зможете:
• назватиодиницю вимірювання кількості речовини;
• пояснитисутність фізичної величини «кількість речовини»;
• обчислюватичисло атомів (йонів, молекул тощо) у певній кількості речовини та кількість речовини за певним числом цих структурних одиниць.
Кількість речовини. Пояснюючи сутність закону збереження маси, ми переконалися, що дуже важливо вміти спостерігати та описувати зовнішні ознаки перебігу хімічних реакцій - явищ, які належать до макросвіту. Однак ще важливішим є вміння пояснювати ці явища, аналізуючи процеси, які відбуваються між структурними частинками, що належать до мікросвіту.
Ви, звичайно, пам’ятаєте, що хімічне рівняння відображає одиничний акт реакції, який побачити неможливо. Адже для того, щоб спостерігати ознаки реакції, необхідно брати досить значні, цілком відчутні кількості речовин. Розгляньмо умови й ознаки перебігу реакції заліза із сіркою (рис. 16.1).
Змішаємо в чашці Петрі подрібнені до порошкоподібного стану залізо й сірку. Розжаримо в полум’ї сталеву спицю й торкнемося нею суміші реагентів. Бурхлива реакція між залізом і сіркою супроводжується виділенням теплової та світлової енергії. Твердий продукт взаємодії цих речовин - ферум(ІІ) сульфід є сполукою чорного кольору.
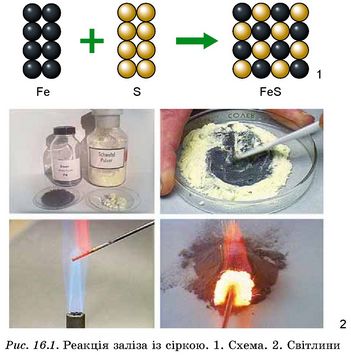
Щоб продемонструвати вам цей дослід, учитель хімії мав попередньо підготувати порції порошкоподібних заліза й сірки. Залізо взято масою 7 г, а сірку - масою 4 г.
Пригадайте закон збереження маси та обчисліть масу продукту цієї реакції, якщо в ній обидва реагенти витратилися повністю:

Проаналізуйте наведені в умові дані та одержані відповіді. Поміркуйте й визначте, яка залежність існує між масами реагентів і продукту реакції.
Чому саме такі маси речовин зазначено в інструкції? Дослідним шляхом визначено, що за такої умови і сірка, і залізо повністю витратяться під час перебігу реакції. Розгляньмо її рівняння:
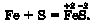
Відповідно до нього атом Феруму сполучається з атомом Сульфуру. Продуктом реакції є ферум(ІІ) сульфід. Отже, можемо обґрунтовано припустити: число атомів Феруму, що міститься в порції заліза масою 7 г, дорівнює числу атомів Сульфуру, яке міститься в порції сірки масою 4 г.
Ви вже знаєте, що атоми, молекули, йони - надзвичайно малі частинки. Саме тому порції речовин, які беруть для проведення хімічних реакцій, характеризуються фізичними величинами, що відповідають великій кількості частинок. Такою фізичною величиною є кількість речовини.
Кількість речовини — фізична величина, яка прямо пропорційна числу структурних одиниць речовини в певній її порції.
Пригадайте скорочені позначення маси та об'єму речовин.
Фізичну величину кількість речовини скорочено позначають літерою латинської абетки n (вимовляємо ен).
Моль — одиниця кількості речовини. Число Авогадро. Як і будь-яка інша фізична величина, кількість речовини має одиниці вимірювання.
Пригадайте: а) одиниці вимірювання маси та об'єму речовин; б) стандартну форму запису числа.
Одиниця кількості речовини — моль - це порція речовини, у якій 6,02 • 1023 структурних одиниць. Слово «моль» походить від латинського слова moles і означає кількість, масу або множину, елементи якої полічені. Із цих трьох понять останнє найточніше виражає сучасне розуміння поняття «моль».
Зверніть увагу: Слово «моль» як позначення одиниці вимірювання не відмінюється (5 моль; 0,25 моль), а як назва одиниці вимірювання (у тексті й усному мовленні) відмінюється як іменник чоловічого роду (чверть моля, сімома молями, трьох молів тощо).
Латинське moles означає вага, брила, масивна структура. На італійській монетці номіналом два центи1 зображено шпиль Mole Antonelliana (Антонеллі-єва громадина) - до 2011 року найвищого будинку в Італії (167,5 м), символу Турина (рис. 16.2).


якої можна визначити такі величини, як, наприклад, маса атома або молекули, заряд електрона тощо.
 |
Рис. 16.3. Авогадро Амедео (1776-1856). Італійський фізик і хімік (юрист за освітою). Популярність його імені пов’язана з відкриттями в галузі фізики й хімії. У 1811 р. заклав підвалини молекулярної теорії. Цього самого року відкрив закон, названий його ім’ям. Винайшов метод визначення молекулярних мас, першим правильно обчислив атомні маси низки хімічних елементів |
То чи насправді число Авогадро таке велике? Щоб осягнути його колосальність, уявіть собі, що на дно Чорного моря висипали шпилькові головки (діаметр кожної близько 1 мм), кількість яких дорівнює числу Авогадро. Тоді б виявилося, що в Чорному морі вже не залишається місця для води: воно з надлишком було б заповнене шпильковими головками. Такою кількістю шпилькових головок можна було б шаром завтовшки близько 1 км засипати площу, яка дорівнює, наприклад, території Франції.
Утім, поняття «моль» застосовуване до будь-яких матеріальних об'єктів. Та для об'єктів макросвіту ця величина втрачає сенс. Наприклад, тенісні м'ячі кількістю 1 моль укрили б поверхню планети Земля шаром завтовшки 100 км. А восьмикласники кількістю 1 моль склали б 6,02 • 1023 школярів, у той час як населення земної кулі становить близько 7,3 мільярдів (7,3 • 109) осіб.
Якби все населення Землі стало лічити молекули, що містяться у воді кількістю 1 моль, то у процесі безупинної лічби кожною людиною по одній молекулі за секунду для виконання роботи потрібно було б близько 4 мільйонів років.

Ці міркування можна відобразити низкою взаємопов’язаних математичних виразів. Вони відбивають пряму пропорційну залежність між кількістю речовини і числом структурних одиниць у її порції:

Скорочено ці співвідношення відображено на рисунку 16.5.
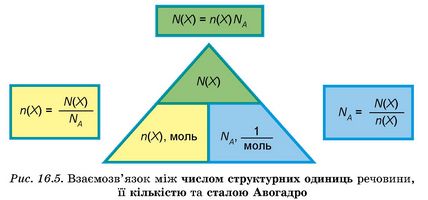
Цю схему зручно використовувати як своєрідний алгоритм для розв’язування задач. Розгляньмо приклади.
Задача 1. Обчисліть число атомів Феруму в залізі кількістю речовини 3 моль.
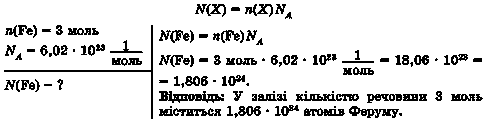
Задача 2. Обчисліть кількість речовини (моль) атомів Сульфуру, порція яких містить 1,204 • 1025 атомів Сульфуру.

ПРО ГОЛОВНЕ
• Кількість речовини - фізична величина, яка прямо пропорційна числу структурних одиниць речовини в певній її порції.
• Фізичну величину кількість речовини скорочено позначають латинською літерою n.
• Одиниця кількості речовини - моль - це порція речовини, яка містить 6,02 • 1023 її структурних одиниць.
• Число 6,02 • 1023 назвали на честь Амедео Авогадро. Якщо числу Авогадро приписати одиницю вимірювання м^, дістанемо фізичну константу - сталу Авогадро. Її позначають Na.
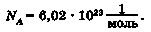
Задача 3. Обчисліть сталу Авогадро, якщо відомо, що ферум(П) сульфід кількістю речовини 10 моль містить 6,0221415 • 1024 структурних одиниць цієї речовини.
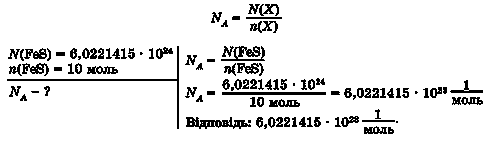
• Існує пряма пропорційна залежність між кількістю речовини і числом
структурних одиниць у її порції. Стала Авогадро є коефіцієнтом пропорційності.
Перевірте себе
1. Що таке кількість речовини? 2. Яка одиниця вимірювання кількості речовини?
3. Як скорочено позначають фізичну величину кількість речовини? 4. Чому дорівнює число Авогадро?
Застосуйте свої знання й уміння
1. Поясніть сутність фізичної величини «кількість речовини».
2. Обчисліть число молекул кисню в його порції кількістю речовини 0,8 моль.
3. Пригадайте хімічну формулу кисню та обчисліть число атомів Оксигену в кисні кількістю речовини 2 моль.
4. Обчисліть кількість речовини (моль) заліза, порція якого містить 2,408 • 1022 атомів Феруму.
5. Обчисліть число молекул у порції води кількістю речовини 15 моль. Скільки атомів: а) Гідрогену; б) Оксигену в цій порції води?
6. Складіть і розв'яжіть кілька розрахункових задач на встановлення взаємозв'язку між числом структурних одиниць речовини, її кількістю та сталою Авогадро.
7. Фізики з MIT-Harvard Centrefor Ultra-Coldatoms (Центру ультрахолодних атомів, створеного спільно Массачусетським технологічним інститутом і Гарвардським університетом) охолодили 2500 атомів Натрію до половини мільярдної частини градуса
вище абсолютного нуля - температури, за якої коливання атомів майже повністю припиняються. Обчисліть кількість речовини (моль) натрію, яку було охолоджено в цьому експерименті.

8. День моля - неофіційне свято, яке відзначають хіміки Північної Америки 23 жовтня між 6 : 02 ранку й 6 : 02 вечора (6 : 02 10/23 в американській нотації часу й дати). У деяких школах США та Канади День моля святкують 2 червня (6/02), а не 23 жовтня (23/10), очевидно, з 10 : 23 ранку до 10 : 23 вечора. Поміркуйте й висловіть припущення, чому для святкувань вибрано саме ці час і дату. Як ви вважаєте, якому науковцеві присвячені ці щорічні урочистості?
9. На емблемі Дня моля зображено крота. Пригадайте уроки англійської, поміркуйте й поясніть, чому саме це звірятко стало символом наукового свята (рис. 16.6).
Творча майстерня
1. Розробіть сценарій проведення наукового свята День моля у вашому навчальному закладі.
2. У сірниковій коробці (її об’єм близько 27 см3) легко помістяться порції багатьох металів кількістю речовини один моль: заліза, міді, алюмінію, срібла, золота, ртуті, цинку, літію, урану. Використайте довідкові дані щодо густин цих металів, виконайте обчислення і перевірте достовірність наведеної інформації.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:04, Переглядів: 4278