Кристалічні ґратки
Кристали здавна привертали людей своїм зовнішнім виглядом: правильними гранями, досконалістю форм. Гарний кристал - прекрасна геометрична фігура. Саме цим його завжди відрізняли від інших -«безформних» - природних утворень.
Р.К. Баландін
Після опрацювання параграфа ви зможете:
• називатитипи кристалічних ґраток;
• наводити прикладисполук з атомними, молекулярними та йонними кристалічними ґратками;
• характеризуватиособливості кристалічної будови речовин з різними видами хімічного зв'язку;
• обґрунтовуватифізичні властивості речовин залежно від їхньої будови;
• прогнозувативластивості речовин залежно від виду хімічного зв'язку і типу кристалічних ґраток.
Майже весь світ є кристалічним. Що означає це твердження видатного науковця О.Є. Ферсмана (рис. 14.1)?
 |
Рис. 14.1. Ферсман Олександр Євгенович (1883-1945) - російський геохімік і мінералог, один з основоположників геохімії, «поет каменю» (Олексій Толстой). Дійсний член, віце-президент (1926-1929) Академії наук, член Імператорського православного палестинського товариства. На його честь названо мінерали ферсміт і ферсманіт |
Для кристалічного стану речовини характерне впорядковане розташування структурних одиниць (атомів, молекул, йонів) у всьому кристалічному тілі незалежно від відстані між частинками.
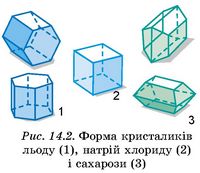
Структурні частинки кристалічних тіл утворюють у просторі правильні кристалічні просторові ґратки. Поверхня кристала обмежена площинами - гранями, лінії перетину яких є ребрами, а точки перетину ребер - вершинами. Кристали можуть мати різну форму (рис. 14.2).
У аморфних (безформних) тіл, на відміну від кристалічних, немає строгого порядку в розташуванні атомів і молекул. Лише найближчі атоми розташовуються в деякому порядку. Але строгої повторюваності в усіх напрямках одного й того самого елемента структури, яка характерна для кристалів, в аморфних тілах немає (рис. 14.3).

Одна й та сама речовина може перебувати як у кристалічному, так і в аморфному стані. Якщо розплавлений цукор охолоджувати повільно, утворюються кристалики. Якщо розплав охолоджувати дуже швидко - одержимо склоподібну масу - льодяник. Через кілька місяців поверхня льодяника вкриється пухкою кірочкою - цукор почне переходити з аморфного до кристалічного стану.
Кристалічні ґратки - модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
В атомних кристалах атоми зв’язані ковалентним неполярним зв’язком. Характерним прикладом таких речовин є алмаз, у кристалічних ґратках якого всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні (рис. 14.4).
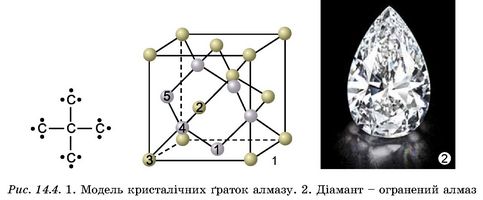
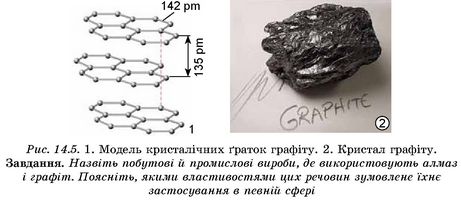
З алмазів особливим огранюванням, що спеціально виявляє його блиск, виготовляють діаманти - дорогоцінне каміння. Алмаз не проводить електричний струм. Це надзвичайно стійка форма існування Карбону, за нагрівання без доступу повітря вище від температури 1200 °С відбувається її перехід у графіт. Кристалічна структура графіту зовсім не схожа на структуру алмазу. Атоми Карбону в графіті розташовані плоскими сітками (рис. 14.5). На відміну від алмазу, графіт непрозорий, чорного кольору, має високу електропровідність, легко розшаровується. Алмаз і графіт -атомні кристали. Відмінність у будові зумовлює відмінність у фізичних властивостях і застосуванні речовин.
Бор, силіцій, германій, арсен, кварц також утворюють атомні кристали. Ці кристали дуже міцні та тверді, погано проводять теплоту й електричний струм. Речовини, що мають атомні кристалічні ґратки, плавляться за високих температур. Наприклад, температура плавлення кварцу 1725 °С. Такі речовини практично нерозчинні в будь-яких розчинниках, мають низьку реакційну здатність.
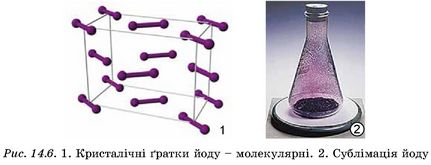
Молекулярні кристалічні ґратки побудовані з молекул речовини. Зазвичай у таких речовин низькі температури плавлення й кипіння, адже молекули слабко зв’язані між собою. Молекулярні ґратки мають у твердому агрегатному стані водень H2, азот N2, кисень O2, галогени (фтор, хлор, бром, йод), чимало органічних речовин. На рисунку 14.6 зображено кристалічні ґратки йоду, у вузлах яких містяться молекули I2. Атоми йоду в молекулі зв’язані досить міцними ковалентними зв’язками, а молекули між собою - слабкими силами. Тому вже за незначного нагрівання йод, не плавлячись, переходить з кристалічного стану в газуватий (сублімується), а за охолодження пара йоду кристалізується (рис. 14.6).
Лід - також молекулярний кристал. Міцність молекулярних кристалів залежить від розмірів і складності молекул.
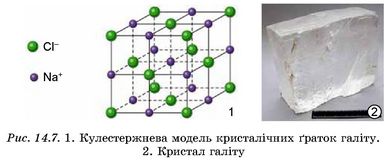
Ионні кристали утворюють більшість солей неорганічних і органічних кислот, луги, основні й амфотерні оксиди й гідроксиди (про ці сполуки ви докладніше дізнаєтеся під час вивчення теми 4). Чи не найтиповіший приклад йонного кристала - галіт (натрій хлорид) (рис. 14.7).
В утворенні йонних кристалів багатьох солей беруть участь катіони металічних елементів та одно- або багатоатомні аніони (формули багатьох з них наведено в таблиці «Розчинність кислот, солей, основ, амфотерних гідроксидів у воді»). У йонних кристалах зв’язки між йонами міцні, тому такі кристали мають високі температури плавлення (801 °С - натрій хлорид, 2627 °С - кальцій оксид тощо). Зазвичай йонні кристали тверді, але крихкі.
Їхня крихкість зумовлена тим, що навіть за невеликої деформації кристала катіони й аніони зсуваються так, що сили відштовхування між однойменними йонами починають переважати над силами притягання між катіонами й аніонами, тож кристал руйнується.
Науково-технологічний комплекс «Інститут монокристалів» НАН України - провідний науковий центр. У травні 2015 р. виграв конкурс НАНУ на постачання монокристалічного сапфіру. Цей стратегічний матеріал буде використовуватися для створення оптичних елементів протидії самонавідним боєголовкам, а також для вдосконалення прозорої броні.
Закріпимо здобуті знання, виконавши лабораторний дослід (індивідуально за порадою вчителя або в малій навчальній групі).
ЛАБОРАТОРНИЙ ДОСЛІД 1
Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови
Неухильно дотримуйтеся правил безпеки під час роботи в кабінеті хімії!
Вам видано натрій хлорид (кухонну сіль), кварцовий пісок, шматочки льоду, сахарозу, ванілін, ментол. Розгляньте ці речовини (за потреби використайте збільшувальне скло). Чи однакової форми їхні кристали? Перевірте, які з речовин розчинні у воді, які - ні. Чи легко їх подрібнити? Наскільки вони легко- або тугоплавкі, термостійкі? Чи мають запах?
Класифікуйте речовини за типами кристалічних ґраток. Результати класифікації запишіть до таблиці. Чи вдалося вам правильно визначити тип кристалічних ґраток, ґрунтуючись на фізичних властивостях досліджуваних речовин? Перевірте свої висновки за додатковими джерелами інформації.
ПРО ГОЛОВНЕ
• Кристалічні ґратки - модель, за допомогою якої описують внутрішню будову кристалів.
• Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: йонні, атомні, молекулярні.
• Молекулярні речовини мають низькі температури плавлення й кипіння.
• Речовини з атомними кристалічними ґратками зазвичай плавляться за високих температур, практично нерозчинні в будь-яких розчинниках, мають низьку реакційну здатність.
• У йонних кристалах зв’язки між йонами міцні, тому такі речовини зазвичай мають високі температури плавлення. Вони тверді, але крихкі.
• Властивості сполук залежать від їхньої будови і зумовлюють застосування речовин.
Перевірте себе
1. Що таке кристалічні ґратки? 2. Що називають вузлами кристалічних ґраток? 3. Які є типи кристалічних ґраток? Які частинки розташовані у вузлах кристалічних ґраток кожного типу? 4. Чим аморфні речовини відрізняються від кристалічних?

Застосуйте свої знання й уміння
1. Спрогнозуйте тип кристалічних ґраток у речовинах за описом їхніх властивостей і застосування: а) камфора (компонент мазей, крапель та інших лікарських форм) - безбарвні леткі кристали з характерним запахом; б) бор нітрид BN (боразон) за твердістю наближається до алмазу, водночас він стійкіший до високих температур. Його використовують для виготовлення надтвердих абразивних матеріалів; в) сухий лід -карбон(ІУ) оксид за атмосферного тиску і звичайної температури зазнає сублімації - випаровується (рис. 14.8). Поясніть, який тип кристалічних ґраток у цієї речовини.
2. У вузлах кристалічних ґраток йоду містяться
А атоми В йони
Б молекули Г електрони
3. Заповніть узагальнювальну таблицю «Типи кристалічних ґраток, види хімічного зв'язку й властивості речовин» за зразком:
Творча майстерня
Ii Виготовте з дроту та кольорового пластиліну (або інших матеріалів) моделі кристалічних ґраток алмазу, графіту, натрій хлориду, йоду, карбон(ІУ) оксиду.
2. Знайдіть інформацію про вирощування кристалів з розчинів речовин. Сплануйте своє дослідження. Обговоріть свій план з учителем, порадьтеся з батьками. Виростіть кристали і підготуйте презентацію свого доробку.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:02, Переглядів: 6855