Стан електронів у атомі. Будова електронних оболонок атомів хімічних елементів. Енергетичні рівні та підрівні. Поняття про радіус атома
Електрон не такий простий, яким здається. Брег Вільям Лоренс

Після опрацювання параграфа ви зможете:
• характеризуватистан електронів у атомах та будову електронних оболонок атомів хімічних елементів;
• розрізняти s- і р-електронні орбіталі за розміром і формою;
• складатиелектронні формули атомів та їхній графічний варіант;
• пояснювати суть поняття «радіус атома»;
• порівнюватирадіуси атомів хімічних елементів.
Стан електронів у атомі описують, використовуючи певні математичні моделі1. Частину простору в атомі, де перебування електрона є найбільш імовірним, називають електронною орбіталлю.
Орбіталь, зайнята електроном, нагадує хмару.
У ній розподілені маса і заряд електрона (пригадайте, як заряджений електрон; якою є маса електрона порівняно з протоном і нейтроном).
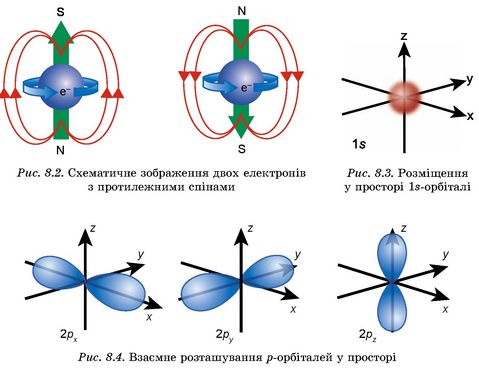
Густина електронної хмари на різній відстані від ядра різна (рис. 8.1). Рух електрона навколо власної осі має назву спін (рис. 8.2). 1
Математична модель - наближений опис об’єкта моделювання за допомогою математичної символіки.
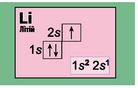
На одній орбіталі одночасно може перебувати не більше двох електронів з протилежними спінами (рис. 8.2). Електронні орбіталі розрізняють за розміром і формою. Орбіталі кулястої форми позначають літерою s. Електрони, орбіталі яких мають кулясту форму, називають s-електронами (рис. 8.3). Орбіталі гантелеподібної форми позначають літерою р. Електрони, орбіталі яких мають гантелеподібну форму, називають p-електронами. р-Орбіталі розміщуються у просторі вздовж трьох взаємно перпендикулярних осей координат (рис. 8.4).
Енергетичні рівні та підрівні. Електронні хмари різних форм до того ж відрізняються силою притягання до ядра, а самі електрони розташовані навколо ядра шарами. Енергія електрона є його найважливішою характеристикою. Електрони, які розташовані в атомі в орбіталях однакової форми і розміру, мають однакову енергію.
З урахуванням енергій електронів їх розподіляють за певними енергетичними рівнями. Максимальну кількість електронів N на енергетичному рівні обчислюють за формулою: Nmax(e) = 2n2, де n - номер енергетичного рівня.
Умовний запис будови електронних оболонок атомів називають електронною формулою. Графічний варіант електронної формули дає уявлення про кількість спарених і неспарених електронів в атомі хімічного елемента.
 |
В атомі Гідрогену один неспарений електрон. А в атомі Гелію в s-орбіталі перебуває два спарених s-електрони з протилежними (це позначено напрямками стрілок) спінами. Енергетичний рівень в атомі Гелію завершений. |
 |
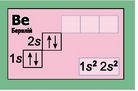
В атомі Літію три електрони. Оскільки перший рівень уміщує лише два електрони, третій електрон займе s-орбіталь другого енергетичного рівня. |
 |
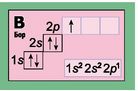
Четвертий електрон атома Берилію також розміститься в s-орбіталі другого енергетичного рівня. |
 |
В атомі Бору п’ятий електрон займе р-орбіталь другого енергетичного рівня. |
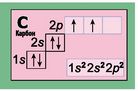 |
Електрони заповнюють орбіталі спочатку по одному. Тому шостий електрон в атомі Карбону займе наступну 2р-орбіталь. |
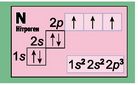 |
За тим самим правилом відбудеться розміщення сьомого електрона в атомі Нітрогену. |
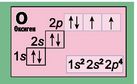 |
В атомі Оксигену на другому рівні немає вільних р-орбіталей. Тому восьмий електрон складе пару одному з р-електронів. |
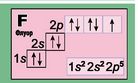 |
Аналогічно відбудеться розміщення дев’ятого електрона в атомі Флуору. |
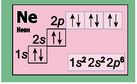 |
В атомі Неону завершується заповнення електронами другого енергетичного рівня. |
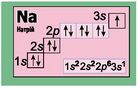 |
3 Натрію починається заповнення електронами третього енергетичного рівня. |
Складіть електронні формули та їхні графічні варіанти для решти атомів хімічних елементів третього періоду. Порівняйте будову зовнішнього енергетичного рівня атомів елементів, які належать до однієї підгрупи.
Зверніть увагу! Електрони спочатку заповнюють орбіталі з нижчою енергією. Енергія 3-d підрівня вища за енергію 4-s підрівня (рис. 8.5). Тому в атомах Калію і Кальцію заповнюється 4-s підрівень, а 3-d підрівень залишається незаповненим. Тобто в атома Калію буде на один s-електрон більше, ніж в атома інертного елемента Аргону. Тому скорочено електронну формулу Калію записують так: [Ar]4s1.
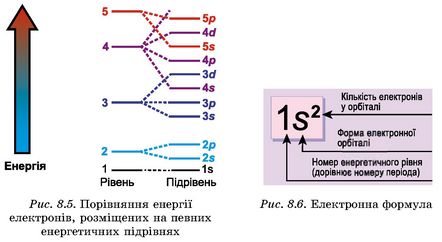
Запишіть скорочено електронну формулу атома Кальцію.
Радіус атома характеризує його розміри. Хоча через особливу природу електрона атоми не мають чітко визначених меж, їхню форму прийнято вважати кулястою. Радіус атома - це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня (рис. 8.7).
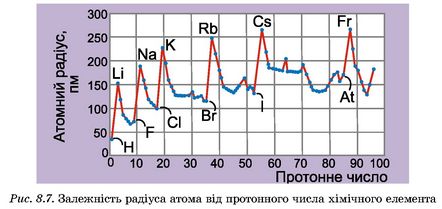
Що більше електронних оболонок має атом, то, вочевидь, його радіус більший. У періодах зі зростанням протонного числа радіус атомів зменшується. Це зумовлено збільшенням величини заряду ядра та кількості електронів на зовнішньому енергетичному рівні - зростає сила притягання між ядром і електронами зовнішнього енергетичного рівня. У головних підгрупах зі зростанням протонного числа радіус атомів зростає.
ПРО ГОЛОВНЕ
• Електронна орбіталь - частина простору в атомі, де перебування електрона є найбільш імовірним.
• Спін - рух електрона навколо власної осі. На одній орбіталі одночасно може перебувати не більше ніж два електрони із протилежними спінами.
• Електрони, орбіталі яких мають кулясту форму, називають s-електронами.
• Електрони, орбіталі яких мають гантелеподібну форму, називають р-елек-тронами.
• р-Орбіталі розміщуються у просторі вздовж трьох взаємно перпендикулярних осей координат.
• Максимальну кількість електронів на енергетичному рівні обчислюють за формулою: Nmax(e) = 2га2, де n - номер енергетичного рівня.
• Умовний запис будови електронних оболонок атомів називають електронною формулою.
• Графічний варіант електронної формули дає уявлення про кількість спарених і неспарених електронів в атомі хімічного елемента.
• Радіус атома - це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
• У періодах зі зростанням протонного числа радіус атомів зменшується. У головних підгрупах зі зростанням протонного числа радіус атомів зростає.
Перевірте себе
1. Що називають електронною орбіталлю? Спіном електрона? 2. Скільки електронів одночасно може перебувати на одній орбіталі? Якими мають бути їхні спіни? 3. Як називають електрони, орбіталі яких мають кулясту форму? 4. Орбіталі яких електронів мають гантелеподібну форму й розміщуються у просторі вздовж трьох взаємно пер-
пендикулярних осей координат? 5. За якою формулою обчислюють максимальну кількість електронів на енергетичному рівні? 6. Що таке електронна формула атома хімічного елемента? 7. Про що дає уявлення графічний варіант електронної формули атома хімічного елемента? 8. Що називають радіусом атома? 9. Як змінюються радіуси атомів у періодах і групах періодичної системи?
Застосуйте свої знання й уміння
1. Обчисліть максимальну кількість електронів на третьому енергетичному рівні.
2. Запишіть електронну формулу атома Алюмінію.
3. Запишіть графічний варіант електронної формули атома Нітрогену й визначте число неспарених електронів у ньому.
4. Визначте хімічний елемент, атому якого відповідає електронна формула ...Zs2Zp2.
5. Виберіть правильний запис електронної формули атома Фосфору:
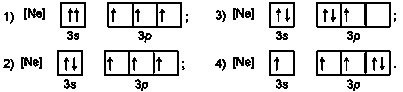
6. Виберіть записи, у яких символи хімічних елементів розміщені за збільшенням радіусів їхніх атомів:
1) Li, B, C, F
2) B, N, C, F
3) Cl, S, Se, Te
4) H, Na, Cs, K
5) Н, Cl, Br, I
Творча майстерня
Змоделюйте, використовуючи повітряні кульки, S- і р-електронні хмари та їхнє взаєморозташування у просторі.
Дізнайтеся більше про стан електронів у атомі:
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 02:58, Переглядів: 4444