Перші спроби класифікації хімічних елементів. Поняття про галогени, лужні та інертні елементи
Після опрацювання параграфа ви зможете:
• описати перші спроби класифікації хімічних елементів;
• наводити приклади лужних, інертних елементів, галогенів;
• пояснити сутність прийому класифікації та його роль у науці.
Спроби класифікації хімічних елементів розпочалися в 60-х роках ХІХ століття. Від найдавніших часів до 1869 р. було відкрито 63 хімічних елементи. Тож виникла нагальна потреба їх систематизувати, адже класифікація завжди встановлює певний порядок (пригадайте принципи наукової класифікації рослин і тварин). Класифікуючи, науковець ділить досліджувану область об’єктів на групи, щоб упорядкувати її та зробити зручною для огляду й вивчення.
Цікаво і пізнавально
Першу таблицю простих речовин уклав А.Л. Лавуазьє в науковій праці «Елементарний курс хімії» (1789). Він класифікував їх за властивостями на метали й неметали.
Науковці помітили, що прості й складні речовини деяких хімічних елементів подібні за складом і властивостями. За цією ознакою елементи об’єднували в групи - природні родини.
Приміром, Флуор, Хлор, Бром, Йод, які належать до природної родини галогенів (Hal), утворюють однотипні речовини складу Hal2, де Hal -це F, Cl, Br, I тощо (рис. 4.1). Гідроген галогеніди (галогеноводні) - речовини із загальною формулою HHal (рис. 4.2) - за звичайних умов - їдкі задушливі гази, добре розчинні у воді. Їхні водні розчини - кислоти.


Завдання. Якого кольору набуває універсальний індикаторний папірець у водному розчині гідроген галогенідів?
Так само подібні між собою лужні елементи - Літій, Натрій, Калій тощо. Усі лужні метали - прості речовини лужних елементів - м’які (їх легко розрізати ножем), із характерним металічним блиском (рис. 4.3).

Завдання. Висловіть припущення, у якого із цих трьох металів густина найбільша. Поясніть, на підставі чого ви дійшли таких висновків
Лужні метали активно реагують з водою. Унаслідок реакцій утворюється луг і виділяється водень: Na + H2O -> NaOH + H2T. Його реактивна сила в момент виділення зумовлює рух шматочка лужного металу поверхнею води.
|
Na ' W шшя* |
Рис. 4.4. Реакція натрію з водою, до якої добавлено індикатор фенолфталеїн. Завдання. Поміркуйте, чому фенолфталеїн набуває малинового кольору в розчині, що утворюється внаслідок реакції натрію з водою. Перетворіть схему реакції натрію з водою на хімічне рівняння |
Загальна формула сполуки лужного елемента з галогеном - EHal. Ці речовини кристалічні (рис. 4.5). Найвідоміша з них - натрій хлорид - кухонна сіль.

Природна родина інертних елементів - Гелій, Неон, Аргон, Криптон, Ксенон і Радон (рис. 4.6). Відповідні одноатомні прості речовини - інертні гази - вирізняються тим, що мають дуже низьку реакційну здатність.

Та всі згадані спроби класифікації хімічних елементів були недосконалими, бо не мали єдиної основи. Тож науковий пошук тривав...
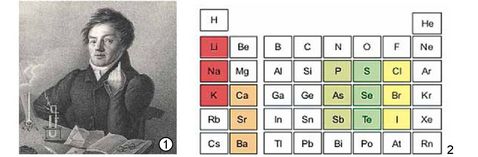
Перша спроба класифікації хімічних елементів за атомними масами. У 1829 році німецький хімік Йоганн Вольфганг Деберейнер (рис. 4.7) під час вивчення властивостей брому встановив, що він посідає проміжне положення між хлором і йодом. У ряду простих речовин хлор - бром - йод науковець виявив не лише поступову зміну кольору й зменшення реакційної здатності, а й поступову зміну мас атомів відповідних хімічних елементів. Пізніше Деберейнер помітив цікаву закономірність для деяких груп елементів (рис. 4.8). Якщо розташувати за зростанням атомних мас три хімічно подібні елементи, то атомна маса середнього члена трійки приблизно дорівнює половині суми атомних мас її крайніх членів. Проте науковець марно намагався знайти інші подібні групи з трьох хімічних елементів.
 |
|
Рис. 4.7. 1. Деберейнер Йоганн Вольфганг (1780-1849). Німецький хімік. Відкрив каталітичну дію порошкоподібної платини (1821). Здійснив спробу класифікації елементів за атомними масами (тріади Деберейнера). 2. Тріади Деберейнера. |
Завдання. Використовуючи періодичну систему хімічних елементів, перевірте існування закономірності, яку виявив Деберейнер
Гвинтовий графік Шанкуртуа. Французький геолог Олександр де Шан-куртуа у 1862 році розташував елементи за зростанням атомних мас і розмістив їх на гвинтовому графіку по спіралі, що огортає циліндр під кутом 45°. Розділивши циліндр на 16 вертикальних ліній, він помітив, що на одну лінію потрапляють аналогічні за хімічними властивостями елементи (рис. 4.8). На підставі цього можна було припустити існування періодичної залежності між властивостями елементів. Публікацію свого повідомлення Шанкуртуа не унаочнив побудованим ним графіком, тож воно залишилося поза увагою інших науковців. До того ж недоліком спіралі де Шанкуртуа було те, що на одній лінії з подібними за властивостями елементами траплялися елементи іншої хімічної природи.

Рис. 4.8. 1. Олександр Еміль Бегюйе де Шанкуртуа (1820-1886). На посаді генерального наглядача гірської справи вжив низку заходів для убезпечення шахт від вибухів. За його ініціативою у Франції почали будувати сейсмічні станції. Запропонував систематизацію хімічних елементів за закономірною зміною атомних мас -так звану земну спіраль, або «циліндр Бегюйе». 2. Гвинтовий графік Шанкуртуа
Октави Ньюлендса. У 1864 р. англійський хімік Джон Ньюлендс (рис. 4.9) розташував відомі на той час хімічні елементи за зростанням атомних мас і пронумерував їх. Науковець виявив певну закономірність у зміні властивостей елементів. А саме: ряд природно розкладається на октави, тобто на рядки із семи елементів, де кожний елемент подібний до однакових за номерами елементів попередньої та наступної октав (рис. 4.10).

Рис. 4.9. Ньюлендс Джон Александер Рейну (1837-1898).
Американський хімік-аналітик, експерт у цукровій промисловості. Систематизував хімічні елементи. Виявлену закономірність у їхньому розташуванні назвав «законом октав». Виявив себе як систематик, що зумів класифікувати вже відоме. Очільники Лондонського королівського товариства в 1887 році присудили Ньюлендсу медаль імені Г. Деві - п’ять років по тому, як такою самою медаллю було нагороджено Д.І. Менделєєва
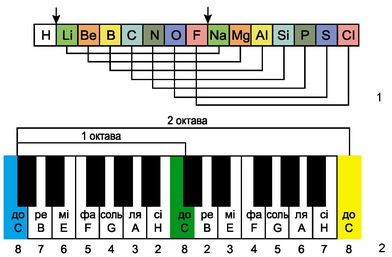
Рис. 4.10. Музика і хімія. 1. Октавою називають ділянку звукоряду, до якої входять усі 7 ступенів - до, ре, мі, фа, соль, ля, сі. Візьмемо як вихідну клавішу до зеленого кольору і надамо їй порядкового номера 1. Відлічимо від неї вісім клавіш ліворуч й отримаємо сусідню клавішу до блакитного кольору з порядковим номером 8. Тепер відлічимо від зеленої клавіші вісім клавіш праворуч й отримаємо клавішу до жовтого кольору також з порядковим номером 8.
2. Кожний восьмий елемент подібний до того, від якого починають відлік
Та окрім рядів, що містили подібні за властивостями елементи, у таблиці Ньюлендса були ряди з елементами, зовсім не схожими між собою. Цю спробу класифікації теж не можна вважати досконалою, тож не дивно, що чимало хіміків поставилися до відкриття Ньюлендса як до малозначного факту.
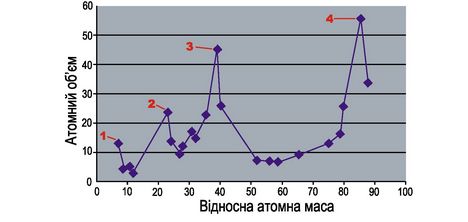
За крок до відкриття закону, який би об’єднав усі хімічні елементи в чітку наочну систему, був німецький хімік Лотар Мейєр (рис. 4.11). Він дослідив залежність атомних об’ємів хімічних елементів від їхніх атомних мас. Графічно цю залежність виражено у вигляді хвиль, що здіймаються гострими піками в точках, які відповідають лужним елементам (рис. 4.12). Кожний спуск та підйом до піку відповідає періоду в таблиці елементів.

Рис. 4.11. Мейєр Лотар Юліус (1830-1895). Німецький хімік, іноземний член-кореспондент Петербурзької АН. У 1864 р. склав таблицю з 27 хімічних елементів, розташованих за зростанням атомних мас і згрупованих за валентністю, однак не зробив теоретичних узагальнень. У 1870 р. (слідом за Д.І. Менделєєвим) уклав повну таблицю хімічних елементів. Побудував криві залежності атомних об’ємів елементів від їхніх атомних мас
 |
|
Рис. 4.12. Криві залежності атомних об’ємів елементів від їхніх атомних мас. Завдання. За допомогою періодичної системи хімічних елементів визначте, яким лужним елементам відповідають піки 1, 2, 3, 4 графіка |
У таблиці, яку опублікував Лотар Мейєр у 1870 р., більшість із 63 відомих на той час хімічних елементів було розміщено за зростанням їхніх відносних атомних мас і згруповано за валентністю. Тобто німецький учений упритул наблизився до відкриття закону, який міг би об’єднати всі хімічні елементи в чітку наочну систему. Однак пріоритет належить іншому науковцю. Чому? Про це ви дізнаєтеся з наступного параграфа.
ПРО ГОЛОВНЕ
• Класифікація - система розподілення предметів за класами на підставі схожості цих предметів усередині класу та їхньої відмінності від предметів інших класів.
• Одна з перших класифікацій хімічних елементів полягала в поділі їх на металічні й неметалічні.
• Галогени, лужні й інертні елементи - природні родини елементів, які
утворюють однотипні сполуки.
• Перші спроби класифікації хімічних елементів були недосконалими, бо
не мали єдиної основи.
Перевірте себе
1. Які були перші спроби класифікації хімічних елементів? 2. За якою ознакою хімічні елементи відносять до металічних? Неметалічних? 3. Які хімічні елементи утворюють природну родину галогенів? Лужних елементів? Інертних елементів?
Застосуйте свої знання й уміння
1. Схарактеризуйте сутність прийому класифікації та його роль у науці.
2. Побудуйте графік Шанкуртуа й перевірте інформацію щодо його переваг і недоліків, наведену в параграфі.
3. Поясніть, якого кольору набуде універсальний індикаторний папірець у розчині, що утворюється внаслідок реакції рубідію з водою.
4. Виберіть одну правильну відповідь.
1) Укажіть лужний елемент.
А Ag Б Cu В Cs Г Br
2) Укажіть галоген.
AFe BN BCa TF
3) Який елемент є інертним?
Al Б Ar BK Г Mg
Творча майстерня
1. Складіть хронологічну таблицю спроб класифікації хімічних елементів та проілюструйте її. Не обмежуйтеся відомостями, наведеними в підручнику. Скористайтеся й іншими джерелами інформації. Чи всіх попередників періодичного закону було згадано в параграфі? Відкрийте однокласникам усю правду про відкриття періодичного закону хімічних елементів.
2. Підготуйте до наступного уроку картки, на яких, використовуючи періодичну систему хімічних елементів, зазначте для перших двадцятьох елементів їхні знаки, назви, відносні атомні маси, значення вищої валентності, формули вищих оксидів та їхніх гідратів.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 02:40, Переглядів: 5363