§ 71. Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів або продуктів реакції за відомими даними про вихідні речовини, одна з яких узята з надлишком
Якщо відомі маси або об’єми декількох речовин, що вступають у реакцію, то кількість речовини продукту реакції потрібно визначати тільки за одним із них, а саме за тим, який витрачається повністю. Усі інші речовини зостануться в надлишку.
Для того щоб дізнатися, яка з речовин прореагує повністю, потрібно порівняти кількості речовин, поділені на відповідні коефіцієнти в рівнянні реакції. Речовина, для якої це відношення найменше, повністю витрачається.
Приклади розв’язування задач
Приклад 1. Обчисліть масу ферум(ІІІ) хлориду, який утворюється внаслідок взаємодії 22,4 г заліза з 17,92 дм3 (и. у.) хлору.

Приклад 2. Яка кількість речовини натрій гідроксиду та який об’єм (н. у.) водню утворяться внаслідок взаємодії 16,1 г натрію і 14,4 г води?

Запитання та завдання
1. Обчислення маси, об’єму (и. у.) або кількості речовини всіх учасників реакції здійснюють за речовиною, яку дано за умовою задачі: а) у надлишку; б) у недостачі; в) за будь-якою на вибір. Яке з тверджень правильне?
2. Як визначають речовину, яку для проведення реакції взято в недостачі?
4 3. Який об’єм (н. у.) водню виділиться під час взаємодії 1,204* IO23 атомів Цинку, що містяться в порції порошку ципку, з хлоридною кислотою? Яка маса солі при цьому утвориться?
4 4. До розчину, що містить 4,25 г аргентум(І) нітрату, додали 0,9 г магнію. Скільки атомів Аргентуму утвориться і чи залишиться ще сіль Аргентуму(І) у розчині після закінчення реакції?
5. У розчин нітратної кислоти помістили 15,3 г барій оксиду. Яку масу солі отримали? Скільки молекул нітратної кислоти вступило в реакцію?
4 6. Є розчин, що містить 0,4 моль натрій гідроксиду, і розчин, який містить 0,25 моль сульфатної кислоти. Яку масу кислоти потрібно витратити на його повну нейтралізацію та скільки молекул води утворяться в результаті цієї реакції?
7. Розчин, який містив 20 г сульфатної кислоти, обробили розчином, що містить 0,2 моль барій хлориду. Яка маса сульфатної кислоти вступить у реакцію та яка кількість речовини солі утвориться?
8. Який об’єм (н. у.) карбон(ІУ) оксиду має вступити в реакцію з 45 г кальцій оксиду, щоб утворилося 0,75 моль солі?
9. Яке число молекул сульфур(УІ) оксиду має вступити в реакцію з 11,8 г калій гідроксиду, щоб маса утвореної солі становила 8,7 г?
10. Яка кількість речовини натрій гідроксиду знадобиться для добування купрум(ІІ) гідроксиду масою 24,5 г з купрум(ІІ) нітрату масою 49 г?
11. Яка кількість речовини нерозчинної солі утвориться внаслідок змішування розчину, що містить 20 г магній сульфату, і розчину, який містить 20 г кальцій нітрату?
12. Який об’єм (н. у.) хлору має вступити в реакцію з 28,8 г порошкоподібної міді, щоб у підсумку отримати сіль кількістю речовини 0,4 моль?
413. Яку масу середньої солі можна добути дією надлишку сульфатної кислоти на 53,5 г ферум(ІІІ) гідроксиду?
14. У надлишок розчину плюмбум(ІІ) нітрату занурили пластинку з цинку масою 13 г. Яка маса свинцю може відновитися, якщо цинк повністю вступив у реакцію відповідно до його положення у витискувальпому ряду металів. До якого типу реакцій її можна віднести?
15. Кальцій карбонат масою 20 г обробили розчином, який містить у надлишку хлоридну кислоту. Яка кількість речовини солі та який об’єм (н. у.) газу утворилися?
Тестові завдання
Виконуючи тестові завдання самостійно, ви зможете перевірити свої знання щодо основних класів неорганічних сполук.
1. Кальцій оксид спроможний взаємодіяти з кожною з трьох сполук, хімічні формули яких наведені в ряду:
а) SO2, H2O, K2O; в) HNO3, N2O5, H2O;
б) NaOH, НС1, MgO; г) Cr(NO3)3, FeCl3, КОН.
2. Карбон(ІУ) оксид спроможний взаємодіяти з кожною з трьох сполук, хімічні формули яких наведені в ряду:
а) HNO3, NaOH, CaCl2; в) Ba(OH)2, Na2O, H2O;
б) MgO, НС1, Cu(NO3)2; г) H2SO1, NaCl, SO2.
3. Алюміній оксид спроможний взаємодіяти з кожною з трьох сполук, хімічні формули яких наведені в ряду:
а) HNO3, NaOH, SO3; в) CaO, КОН, CuSO1;
б) FeO, NaNO3, H2SO,; г) ZnO, H2O, HNO3.
4. На продукт реакції повного згоряння 4,8 г вуглецю подіяли розчином натрій гідроксиду й отримали середню сіль масою:
а) 34,8 г; б) 38,6 г; в) 42,4 г; г) 46,4 г.
5. Калій гідроксид у водному розчині взаємодіє з кожною з трьох солей, хімічні формули яких наведені в ряду:
а) Mg(NO3)2, ZnSO,, BaCl2; в) CuSO,, Mg(NO3)2, MnCl2;
б) КС1, FeSO,, Ca(NO3)2; г) CaCl2, Fe(NO3)3, NaCl.
6. Натрій гідроксид взаємодіє з кожною зі сполук, назви яких наведені в ряду:
а) кальцій оксид і калій гідроксид;
б) сульфур(ІУ) оксид і хлоридна кислота;
в) манган(ІІ) оксид і ферум(ІІІ) сульфат;
г) карбон(ІУ) оксид і калій метасилікат.
7. Цинк гідроксид взаємодіє з кожною зі сполук, хімічні формули яких наведені в ряду:
а) NaOH, HCl, CaCO3; в) Ba(OH)2, Mg(NO3)2, H2SO,;
б) HNO3, H2SiO3, CuSO,; г) КОН, HNO3, SO3.
8. Для одержання 18,5 г кальцій гидроксиду Ca(OH)2 із CaO витратили 1,505* IO23 молекул води. Яке число молекул води необхідне для добування NaOH і Ba(OH)2 такої самої маси з відповідних оксидів?
а) 1,4*10“ і 6,5-1022 молекул; в) 2,2-1023 і 7,3-1022 молекул;
б) 1,8-1023 і 6,9-1022 молекул; г) 2,6-1023 і 7,7-1022 молекул.
9. Цинк оксид взаємодіє з кожною зі сполук, хімічні формули яких наведені в ряду:
а) КОН, MgCO3, Ni; в) H2SO,, Ca(OH)2, MgO;
б) BaO, SO3, S; г) Al(OH)3, Ag, CO2.
10. Розведена сульфатна кислота реагує з усіма сполуками ряду:
а) MgCl2, CO2, Ba(NO3)2; в) Cu, MgO, N2O5;
б) Na2CO3, КОН, Ni; г) SiO2, KNO3, Fe(OH)2.
11. Для одержання 1,806* IO23 молекул ортофосфатної кислоти витратили фосфор(У) оксид масою 21,3 г. Які маси відповідних оксидів необхідні для отримання H2SO1 і HNO3 з таким самим числом молекул?
а) 29,4 і 21,6 г; б) 27,6 і 19,8 г; в) 25,8 і 18,0 г; г) 24,0 і 16,2 г.
12. Якою речовиною потрібно подіяти у водному розчині на магній гідросульфат, щоби перетворити його на магній сульфат?
a) SO3; б) N2O5; в) MgO; г) SO2.
13. У якій з реакцій можливе утворення основної солі?
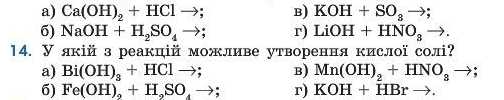
15. Сполука складу (CaOH)2S має назву:
а) кальцій дигідроксосульфід;
б) кальцій гідрогенсульфід;
в) кальцій гідроксосульфід;
г) кальцій дигідрогеисульфід.
16. Хрому(ІІІ) гідрогенортофосфат має хімічну формулу:
а) Cr2(HPO1)3; в) Cr(H2PO1)3;
б) [Cr(OH)J2PO1; г) (CrOH)3(PO1)2.
17. Сполука складу Mg(HCO3)2 має назву:
а) магній гідроксокарбопат;
б) магній карбонат;
в) магній гідрогенкарбоиат;
г) магній дигідроксокарбонат.
18. Розчин якої із солей взаємодіє із залізом?
а) розчин CaCl2; в) розчин CuSO1;
б) розчин Na2CO3; г) розчин Zn(NO3)2.
19. Унаслідок дії хлоридної кислоти на суміш порошкоподібного магнію та його оксиду масою 6,4 г виділилося 2,24 дм3 (н. у.) водню. Яка маса солі утворилася в результаті реакції?
а) 19 г; б) 25 г; в) 31 г; г) 37 г.
20. До розчину, що містив 0,1 моль сульфатної кислоти, додали 0,05 моль магній гідроксиду, а потім розчин повністю випарували. Яка сіль та якою масою утворилася?
а) MgSO1 масою 13,4 г; в) Mg(HSO1)2 масою 10,9 г;
б) (MgOH)2SO1 масою 12 г; г) Mg(SO1)2 масою 5,8 г.
Найважливіше в розділі 5
• Складні речовини, або хімічні сполуки, поділяють на такі основні класи: оксиди, кислоти, основи, солі, амфотерні гідроксиди.
• Оксиди — сполуки, які складаються з двох хімічних елементів, один з яких Оксиген. Більшість оксидів реагує або з кислотами, або з лугами з утворенням солі та води. Оксиди, які реагують тільки з лугами, називають кислотними. Будь-якому кислотному оксиду відповідає кислота. Оксиди, які реагують тільки з кислотами, називають основними. Кожному такому оксиду відповідає основа. Оксиди, що спроможні взаємодіяти як з основами, так і з кислотами, називають амфотерними. За певних умов кислотні оксиди можуть взаємодіяти з основними й амфотерними оксидами, а основні оксиди — з кислотними та амфотерними оксидами.
• Кислоти складаються з атомів Гідрогену, здатних заміщуватися на атоми металічних елементів, і кислотних залишків. Кислоти мають кислий смак, змінюють забарвлення індикаторів, взаємодіють з активними металами, основними й амфотерними оксидами, основами та амфотерними гідроксидами. У всіх цих реакціях утворюються солі. За певних умов кислоти реагують із солями.
• Основи складаються з атомів металічних елементів, з’єднаних із гідроксильними групами. Число гідроксильних груп у складі основ дорівнює валентності металічних елементів. Розчинні у воді основи називають лугами. їх розчини їдкі й милкі на дотик, вони змінюють забарвлення індикаторів. Луги можна отримати під час взаємодії активного металу або оксиду цього металічного елемента з водою. Усі основи реагують із кислотами (реакція нейтралізації), а луги — ще і з кислотними й амфотерними оксидами та амфотерними гідроксидами, а якщо утворюється осад — із розчинами солей.
• Солі складаються з атомів металічних елементів і кислотних залишків. їх можна вважати продуктом заміщення атома Гідрогену кислоти на металічний елемент або продуктом заміщення гідроксильних груп основи на кислотні залишки. Солі вступають у такі реакції: активніший метал (нерозчинний у воді і такий, що у витиску вальному ряду металів стоїть після магнію, у тому числі й останній) витискує менш активні з розчинів їхніх солей. Солі спроможні вступати також у реакції обміну з іншими солями, розчинами кислот і лугів. Реакції обміну відбуваються, якщо в результаті утворюється осад, га-зувата речовина або вода.
• Речовини різних класів генетично взаємозв’язані.
ПРАКТИКУМ
Правила техніки безпеки під час роботи в кабінеті хімії
1. Під час виконання дослідів будьте якомога більш обережними, щоб не спричинити нещасного випадку. Підтримуйте чистоту та порядок на робочому місці.
2. Докладно вивчіть опис досліду. Виконуйте лише ті хімічні досліди, які подано в описі.
3. Працюйте в кабінеті хімії в захисному халаті, окулярах та рукавичках.
4. Уважно прочитайте етикетку з назвою або формулою на посудині з реактивом, який потрібен для досліду. Не використовуйте посудини з реактивами, на яких немає етикеток.
5. Реактиви для дослідів беріть спеціальними шпателями, ложечками або пінцетами в кількостях, які зазначено в описі досліду.
6. Беріть суху речовину в такій кількості, щоб вона тільки вкрила дно пробірки, а рідину — не більш ніж 1/6 об’єму пробірки.
7. Надлишок узятого реактиву не зсипайте (не зливайте) назад у посудину, де його зберігали, а поміщайте лише в спеціальні склянки.
8. Відкривши банку з реактивом, кладіть корок па стіл догори низом.
9. Коли наливаєте рідину, беріть посудину з реактивом так, щоб етикетка була спрямована вгору, і знімайте корком краплю з шийки посудини.
10. Закрийте відразу корком посудину, з якої узяли реактив, і поставте її на місце.
11. Не пробуйте реактиви на смак.
12. Нюхайте речовини обережно, тримаючи посудину на відстані та спрямовуючи до себе пару чи газ рухами долоні.
13. Користуйтеся пробіркотримачем під час нагрівання розчинів у пробірці. Стежте за тим, щоб отвір пробірки був спрямований у бік від вас та інших осіб, тому що рідина внаслідок перегрівання може вихлюпнутися з пробірки.
14. Ніколи не нагрівайте пробірку тільки знизу, треба рівномірно прогрівати всю пробірку та її вміст.
15. Під час нагрівання рідини стежте за тим, щоб стінки посудини не перегрівалися, оскільки посудина може тріснути.
16. Будьте особливо обережними під час роботи з лугами та кислотами. У разі потрапляння розчину лугу чи кислоти па руки або в очі негайно змийте його великою кількістю води.
17. Будьте дуже обережними під час роботи з нагрівними та електричними приладами.
18. Зливайте відпрацьовані реактиви після їх нейтралізації в раковину або спеціальну посудину, а цінні реактиви — у спеціальний хімічний посуд.
19. Після закінчення роботи приберіть своє робоче місце та ретельно вимийте руки.
Практична робота 1
Хімічні явища
Реактиви: мідна пластинка (або дріт), залізний цвях, залізні ошурки, гідроген пероксид, манган(ІУ) оксиду, розчин купрум(ІІ) сульфату, розчин калій йодиду, кальцій карбонат, розбавлена кислота (хлоридна або нітратна).
Обладнання: пробірки, скляні палички, ніж, пінцет, шпатель, спиртівка.
Мета роботи: спостерігати явища, якими супроводжуються хімічні реакції.
Хід роботи
І. Проведіть досліди.
Дослід 1. Прожарте в полум’ї мідну пластинку або дріт. Потім витягніть із полум’я, зіскребіть ножем на клаптик паперу чорний наліт, що утворився на поверхні пластинки. Повторіть це декілька разів.
Порівняйте фізичні властивості утвореного чорного порошку і металічної міді: агрегатний стан, колір, металічний блиск, пластичність.
Яке явище ви спостерігали в цьому досліді? До якого типу хімічних реакцій відносять цю реакцію? Складіть рівняння реакції.
Дослід 2. Налийте в пробірку приблизно 1 см3 гідроген пероксиду H2O2 і додайте його у пробірку, що містить трохи манган(ІУ) оксиду MnO2. Що ви спостерігаєте? Опустіть у пробірку тріску, що жевріє. Скіпка загоряється. Який газ виді-
ллється? Які зовнішні ефекти підтверджують, що відбулася хімічна реакція? Дізнайтеся про роль MnO2, склад якого при цьому не змінюється.
Дослід 3. Налийте в пробірку розчин купрум(ІІ) сульфату CuSO1 (не більше чверті її об’єму) і занурте у нього очищений залізний цвях. Чи змінюється колір поверхні гвіздка? Вийміть гвіздок із розчину, роздивіться його. Насипте в той самий розчин трохи залізних ошурок. Що спостерігаєте? Забарвлення розчину змінюється: з якого кольору на який? Чому? Які ознаки свідчать, що відбулася хімічна реакція? Складіть рівняння хімічної реакції. Який з досліджених металів найбільш активний?
Дослід 4. Шматочок кальцій карбонату (крейди чи мармуру) покладіть у пробірку і додайте до нього по краплях розбавлену кислоту (хлоридну або нітратну). Що ви спостерігаєте? Якими зовнішніми ефектами супроводжується проведена хімічна реакція?
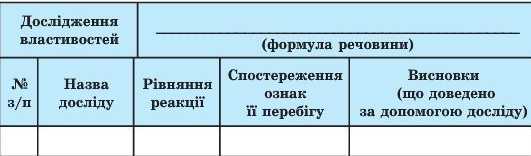
Складіть звіт за такою таблицею.
|
№ з/п |
Назва досліду |
Рівняння реакції |
Спостереження ознак її перебігу |
Висновки (що доведено за допомогою досліду) |
II. Дайте відповіді на запитання.
1. Визначте, які явища слід віднести до фізичних, а які до хімічних: а) розтавання льоду; б) випарювання води; в) горіння свічки; г) утворення нальоту на посудині після висихання природної води; ґ) пожовтіння листя на деревах; д) перегоряння вольфрамової нитки в лампі розжарювання; е) горіння магнію; є) плавлення заліза; ж) виготовлення з мідного дроту спіралі; з) кристалізація цукру в результаті вимерзання води; и) світіння бенгальського вогню; і) іржавіння виробів із заліза.
2. Наведіть приклади хімічних явищ, перебіг яких відбувається: а) під дією світла; б) під час нагрівання.
Практична робота 2
Дослідження властивостей
основних класів неорганічних сполук
Реактиви: кальцій оксид, цинк оксид, сильно газована вода, хлоридна кислота з w (HCl) = 20 %, розчин «вапняної води»; стружки магнію, гранули цинку й міді, розведена сульфатна кислота з w (H2SO1) = 25 %, розчин лакмусу, гранули натрій гідроксиду, шматочки Ca(OH)2 і Cu(OH)2; карбон(ІУ) оксид, розчини купрум(ІІ) хлориду, калій гідроксиду, ферум(ІІІ) хлориду, плюмбум(Н) нітрату, купрум(ІІ) сульфату, мазиій сульфату.
Обладнання: пробірки, скляні палички, годинникове скло, аапарат Кіппа.
Мета роботи: дослідити властивості основних класів неорганічних сполук.
Хід роботи
1. Проведіть досліди.
Дослід І. Дослідження властивостей оксидів
Помістіть у пробірки 1 і 2 кальцій оксид, у пробірки 3 й 4 — цинк оксид, у пробірки 5 і 6 — сильно газовапу воду.
Прилийте в пробірки 1, 3 та 5 хлоридну кислоту з масовою часткою w (HCl) = 20 %.
Що спостерігаєте в пробірках 1 та 3? у пробірці 5?
Прилийте у пробірки 2 і 4 розчин натрій гідроксиду, а в пробірку 6 — розчин «вапняної води». Що спостерігаєте в пробірці 6? Що відбулося в пробірці 4? Чому в пробірці 2 не відбувається ніяких змін?
Дослід 2. Дослідження властивостей кислот
Помістіть в одну пробірку одиу-дві стружки магнію, у другу й третю відповідно по одній-дві гранули цинку та міді. Прилийте в кожну пробірку розчин розведеної сульфатної кислоти з масовою часткою w (H2SO1) = 25 %. Що відбувається з металами у двох перших пробірках? Який газ при цьому виділяється? Чому змін у третій пробірці не відбулося?
В інші три пробірки помістить по 2-3 краплі розчину лакмусу й додайте в одну пробірку гранулу NaOH, у другу — кілька шматочків Ca(OH)2, у третю — кілька шматочків Cu(OH)2. Що спостерігаєте? Чи змінилося забарвлення індикатора? Приливайте в кожну пробірку по краплях розчин розбавленої сульфатної кислоти. Що спостерігаєте? Чи з різною швидкістю відбувається зміна забарвлення індикатора? Чому?
Дослід 3. Дослідження властивостей основ
Покладіть по 2-3 гранули натрій гідроксиду на годинникове скло й залишіть його на повітрі. За 15-20 хв спостерігайте зміни, що відбулися зі зразками лугу. Які зміни відбулися й чому?
У пробірку з розчином кальцій гідроксиду пропустіть з апарата Кінна карбои(ІУ) оксид. Що спостерігаєте? Чому?
Прилийте в одну з пробірок розчин купрум(П) хлориду, а в другу — розчин калій гідроксиду. Що спостерігаєте в кожному із цих випадків? Чому?
Дослід 4. Дослідження властивостей солей
У дві пробірки налийте розчин NaOH. Прилийте в одну з пробірок розчин ферум(ІП) хлориду, а в другу — плюмбум(ІІ) нітрату. Що спостерігаєте? Чому?
Прилийте в третю пробірку розчин купрум(ІІ) сульфату, а в четверту — магній сульфату. Додайте до цих розчинів по гранулі цинку. Що спостерігаєте? Чому?
2. Складіть звіт за такою таблицею.
Практична робота З
Добування цинк гідроксиду та доведення його амфотерності
Реактиви: розчин цинк хлориду, розчин натрій гідроксиду, розчин хлоридної кислоти.
Обладнання: дві пробірки, штатив для пробірок, три піпетки.
Мета роботи: одержати цинк гідроксид і довести наявність його кислотних та основних властивостей.
Хід роботи
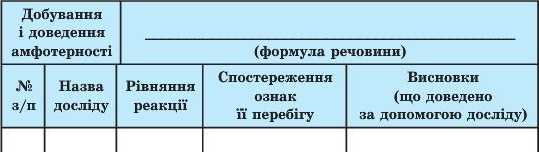
Добування основи Zn(OH)2 та доведення її амфотерності здійснюють за такою схемою.
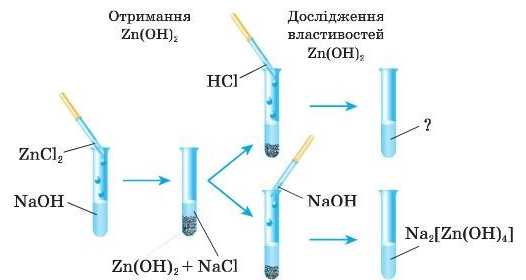
1. У пробірку з розчином лугу NaOH додайте розчин солі ZnCl2. Спостерігайте утворення білого драглистого осаду. Доповніть рівняння реакції:

2. Злийте після відстоювання розчин солі NaCl, яка утворилася одночасно з осадом нерозчинної основи Zn(OH)2. Частину одержаного цинк гідроксиду перенесіть у другу пробірку та дослідіть його хімічні властивості:
а) в одну з пробірок до нерозчинної основи додайте розчин хло-ридної кислоти. Що спостерігаєте? Доповніть рівняння реакції:
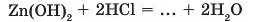
б) випарте одержаний розчин. Що спостерігаєте?
Які властивості — кислотні чи осно'впі — виявляє цинк гідроксид у реакції з кислотою?
в) У ДРУГУ пробірку із цинк гідроксидом додайте розчин лугу. Що спостерігаєте?
За звичайних умов реакція відбувається за рівнянням:
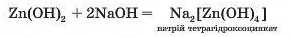
Які властивості — кислотні чи основні — виявляє цинк гідроксид у реакції з основою?
3. Проаналізуйте одержаний результат: за звичайних умов Jr7TBopHBCfl розчин натрій тетрагідроксоцинкату — комплексної сполуки.
4. Звіт про викопану роботу оформіть у вигляді таблиці.
Практична робота 4
Розв'язування експериментальних задач
Реактиви: мідь (мідна пластинка), алюміній і мідь (ошурки), алюміній оксид, натрій хлорид, кальцій оксид, розчини натрій сульфату, лугу, кислоти, магній гідроксид, магній оксид, купрум(ІІ) оксид, ферум(ІІІ) сульфат, цинк оксид, індикатори.
Обладнання: хімічний посуд.
Мета роботи: застосувати набуті знання до розв’язування експериментальних задач з теми.
Хід роботи
Учотирьох розподіліть між собою по 2-3 задачі. Після розв’язування оформіть їх у зошиті, обговоріть та оцініть роботу один одного.
Уважно прочитайте умову задачі, складіть план експерименту, проведіть його за допомогою виданих вам реактивів, напишіть рівняння відповідних реакцій.
Задача 1. За допомогою якого з хімічних реактивів можна обчистити поверхню мідної пластинки від нальоту? Зробіть це й поясніть. Візьміть до уваги те, що до складу нальоту входить суміш Cu(OH)2 і CuCO3, а також CuO. Складіть рівняння відповідних реакцій.
Задача 2. Вам видано суміш ошурків алюмінію та міді. За допомогою неорганічних речовин якого класу можна відділити від цієї суміші ошурки міді? Яким рівнянням реакції це можна підтвердити?
Задача 3. Вам видано суміш порошкоподібних речовин білого кольору алюміній оксиду, натрій хлориду та кальцій оксиду. Як можна визначити, що в цій суміші є кальцій оксид? Яким рівнянням реакції і яким індикатором це можна підтвердити?
Задача. 4. Яким чином можна визначити, у яких пробірках, виданих вам, міститься розчин натрій сульфату, розчин лугу,
розчин кислоти? Яким індикатором краще скористатися під час розв’язування цієї задачі?
Задача 5. Як дослідним шляхом підтвердити, що магній гідроксид виявляє основні властивості? Якими рівняннями це можна підтвердити?
Задача 6. Як дослідним шляхом підтвердити, що магній оксид виявляє основні властивості? Якими рівняннями це можна підтвердити?
Задача 7. Якщо ви маєте купрум(ІІ) оксид, то як із нього можна одержати купрум(ІІ) нітрат? Якими рівняннями це можна підтвердити?
Задача 8. Якщо ви маєте ферум(ІІІ) сульфат, то як із нього можна одержати ферум(ІІІ) гідроксид? Якими рівняннями це можна підтвердити?
Задача 9. Якщо ви маєте цинк оксид, то як із нього можна одержати цинк сульфат? Якими рівняннями це можна підтвердити?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:54, Переглядів: 6358