§ 61. Загальні способи добування основ. Використання основ
У цьому параграфі ви дізнаєтеся:
• як спосіб добування основи залежить від її спроможності розчинятися у воді;
• який спосіб одержання основ називають прямим, а який — посереднім;
• де використовують основи.
Добування основ. Способи одержання основ залежать від того, яку основу потрібно добути: розчинну чи нерозчинну.
Такий спосіб називають прямим.
Демонстраційний дослід

Спосіб одержання розчинної основи полягає у взаємодії відповідного металу або його оксиду з водою:
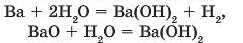
Опустимо в посудину з водою шматочок натрію розміром з горошину. Він спливає, оскільки трохи легший за воду (його густина 0,97 г/см3). У ході реакції виділяється значна кількість теплоти. Через це натрій плавиться (його температура плавлення 98 С), перетворюючись на блискучу краплю, що швидко пересувається поверхнею води і зменшується в розмірах (рис. 67). Фенолфталеїн забарвлює одержаний розчин у малиновий колір. Це свідчить про утворення лугу NaOH. Крім того, виділяється газ:
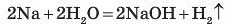
Якщо до отвору пробірки піднести запалену тріску, то почується характерний звук. Так згоряє тільки водень H2. Ще більш енергійно взаємодіє з водою калій. Останній навіть загоряється від стикання з водою. Менш енергійно, ніж натрій, реагує з водою кальцій.
Від чого ж залежить інтенсивність взаємодії металів із водою? Як ви вже знаєте, за звичайних умов з водою взаємодіють лише метали, які стоять у витискувальному ряду металів до магнію. Тепер ви, мабуть, здогадаєтеся, що чим ближче до початку витиску вального ряду стоїть метал, тим енергійніше він взаємодіятиме з водою, тобто тим скоріше утвориться та чи інша основа.
Нерозчинні основи добувають посереднім способом, тобто взаємодією розчинної солі металу, основу якого потрібно добути, з лугом:
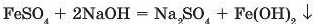
Якщо сіль або основа нерозчинні, то реакція не відбувається. Цим самим методом користуються і для добування деяких розчинних основ:
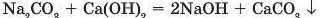
Через те що внаслідок реакції утворюється натрій гідроксид, який ще називають «каустиком», подібний спосіб добування основ отримав назву «метод каустифікації».
До основ, і зокрема лугів, відносять і гідрат аміаку складу NH3 • H2O (його ще називають нашатирним спиртом). Він утворюється в процесі розчинення аміаку NH3 у воді. Його лужні властивості виявляються внаслідок дії на водні розчини індикаторів. Так, нейтральний лакмус у водному розчині аміаку забарвлюється у синій колір, фенолфталеїн — у малиновий, а метилоранж — у жовтий. Це вказує на наявність у такому розчині гідроксильних груп ОН.
Подібно до лугів NH, • ILO взаємодіє з кислотами та солями:

Використання основ. Найпоширенішими основами в промисловості й лабораторній практиці є NaOH, KOH і Ca(OH)2.
Натрій гідроксид має ще й такі назви, як «їдкий натр», «каустична сода», «каустик». Це біла кристалічна гігроскопічна речовина, тобто така, що спроможна поглинати водяну пару з повітря. Натрій гідроксид плавиться й кипить без розкладання, добре розчиняється у воді з виділенням великої кількості теплоти. Він поглинає вуглекислий газ CO2 з повітря й поступово перетворюється на Na2CO3. Тому NaOH потрібно зберігати в добре закупореній посудині. Водні розчини NaOH руйнують скло, а в розплавленому стані — навіть і платину.
Використовують натрій гідроксид для очищення нафти та нафтопродуктів, у виробництві паперу, мила, штучного волокна, для осушування газів, застосовують у срібно-цинкових гальванічних елементах (акумуляторах).
Калій гідроксид, який ще називають «їдке калі», як і NaOH, біла тверда кристалічна речовина, що добре розчиняється у воді. Розчинення у воді супроводжується виділенням великої кількості теплоти. Досить термостійка речовина, яка плавиться без розкладання на оксид і воду. Енергійно поглинає вологу й вуглекислий газ із повітря, тому його використовують для осушування газів, у виробництві мила, інших сполук Калію, у лужних акумуляторах.
Кальцій гідроксид має ще й такі назви: «гашене вапно», «пушонка». Це білий пухкий порошок. У разі змішування його з водою утворюється так зване «вапняне молоко». Оскільки у воді кальцій гідроксид розчиняється в невеликій кількості, то, відфільтрувавши вапняне молоко, можна отримати його прозорий розчин — вапняну воду. На відміну від лугів NaOIi і KOH кальцій гідроксид під час нагрівання розкладається на CaO та воду.
Цю реакцію використовують для затвердіння будівельного розчину. На рис. 68 видно, що в результаті випалення вапняку CaCO3 отримують палене (негашене) вапно CaO:
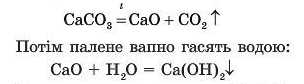


Кальцій гідроксид добре поглинає вуглекислий газ з утворенням нерозчинної солі CaCO •
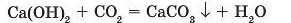
Отримане гашене вапно Ca(OH)2 змішують із піском і водою і цю суміш (так званий будівельний розчин) застосовують під час мурування або оштукатурювання (рис. 69). Під впливом повітря, у якому міститься вуглекислий газ, гашене вапно перетворюється на нерозчинну сіль CaCO3, що скріплює мурування, і воду, яка випаровується.
У хімічній промисловості кальцій гідроксид використовують у виробництві скла, для добування NaOH і деяких солей Кальцію. Кальцій гідроксид застосовують для пом’якшення води та нейтралізації кислих ґрунтів.
і Запитання та завдання
3 1. Як називають спосіб одержання: a) NaOH із металічного натрію; б) Sr(OH)2 зі стронцій оксиду?
2. Нерозчинні основи можна добути: а) взаємодією розчинних солей металічних елементів із лугами; б) взаємодією нерозчинних солей із лугами; в) взаємодією розчинних солей із нерозчинними основами. Наведіть приклади можливих взаємодій.
0 3. Який метод одержання основ називають каустифікацією? Яку основу називають каустиком? Наведіть приклади.
4. Яка з основ — гідроксид літію, стронцію чи феруму(ІІ) — є нерозчинною? Наведіть рівняння реакцій одержання кожної з указаних основ.
5. Є літій оксид, кальцій оксид і манган(П) оксид. За допомогою рівнянь яких реакцій із наведених оксидів можна добути відповідні основи? Які із запропонованих способів одержання основ відносять до прямих, а які — до посередніх?
* 6. Чи з усіх речовин, формули яких FeO, FeSO1, FeS, можна
одержати ферум(П) гідроксид? Складіть рівняння можливих реакцій за умови, що вони мають перебігати в одну стадію: вихідна речовина + невідома сполука. Яка маса ферум(ІІ) гідроксиду утвориться, якщо кількість вихідної речовини становила 0,15 моль?
* 7'. Чи з усіх речовин, формули яких BaO, Ba, BaCO3, можна одержати барій гідроксид? Складіть рівняння можливих реакцій за умови, що вони мають перебігати в одну стадію: вихідна речовина + невідома сполука. У випадку якої з можливих реакцій одержання барій гідроксиду число витрачених молекул невідомої сполуки буде вдвічі більшим (яким саме?), якщо маса гідроксиду, добутого в усіх випадках, була однаковою й дорівнювала 34,2 г?
* 8. Для одержання основ, нерозчинних у воді, з відповідних
оксидів є характерним такий ланцюг перетворень: основний оксид —» ? —> основа.
Яку масу манган(ІІ) оксиду потрібно витратити, щоб у підсумку одержати 26,7 г мапгал(ІІ) гідроксиду?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:48, Переглядів: 3493