§ 60. Хімічні властивості основ: взаємодія із солями та розкладання внаслідок нагрівання
У цьому параграфі ви дізнаєтеся:
• чому основи взаємодіють тільки з деякими солями;
• чи всі основи спроможні розкладатися під час нагрівання.
Взаємодія основ із солями. Реакція відбувається, як правило, за участі розчинних у воді основ і солей. Продуктами реакції є нова основа й нова сіль. У такому випадку принаймні один із продуктів реакції має бути нерозчинним у воді:
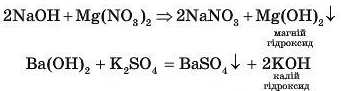
Щоб не припуститися помилок у доборі прикладів для ілюстрації цієї властивості, слід довідатися про розчинність солі в таблиці розчинності кислот, основ і солей у воді (див. форзац).
Нагадуємо, що такі реакції відносять до реакцій обміну.
Особливості розкладання нерозчинних основ у результаті нагрівання. Нерозчинні у воді основи розкладаються під час нагрівання на відповідний оксид і воду:
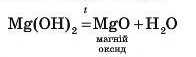
Температури розкладання (термічне розкладання) різних основ дуже відрізняються між собою. Так, наприклад, Ni(OH)2 розкладається вже за температури 300 °С, Mg(OH)2 — 480 °С, a Bi(OH)3 повністю розкладається лише за температури 600 °С. Те ж стосується й лугів. Наприклад, Ca(OH)2 розкладається
вже за температури 500 С, у той час як NaOH і KOH розкладаються тільки під дією електричного струму.

Лабораторний дослід 9
Термічне розкладання нерозчинних основ
• У суху пробірку покладіть трохи бісмут(ІІІ) гідроксиду, зверніть увагу на його колір.
Закріпіть пробірку з бісмут(ІІІ) гідроксидом у лапці штатива так, як показало на рис. 66. Обережно нагрівайте над полум’ям пальника спочатку всю пробірку, а потім ту її частину, де міститься бісмут(ІП) гідроксид. Що відбувається? Коли повністю зміниться колір узятої речовини, нагрівання припиніть. Що сталося з бісмут(ІІІ) гідроксидом?
• Після охолодження пробірки вийміть її зі штативу й обережно додайте кілька крапель сульфатної кислоти з масовою часткою IV (H2SO1) = 40-45 %. Спостерігайте за зміною забарвлення й агрегатного стану сполуки в пробірці. Чому змінився її колір та агрегатний стан? Формули яких речовин потрібно поставити в схемі реакції?
Приклад розв’язування задач
Скільки молекул нітратної кислоти та яка кількість речовини магній гідроксиду прореагувала між собою, якщо внаслідок реакції одержали сіль масою 37 г?

Запитання та завдання
1. Однією з умов перебігу реакції між сіллю й основою є таке: а) сіль та основа мають бути розчинними у воді; б) або тільки сіль, або тільки основа мають бути розчинними у воді; в) сіль та основа мають бути нерозчинні у воді.
2. Розчинні чи нерозчинні основи обов’язково мають розкладатися під час нагрівання?
3. Яких правил безпеки слід дотримуватися під час приготування розчинів лугів?
4. У трьох пробірках містяться зразки твердих речовин: натрій гідроксиду, кальцій гідроксиду та магній гідроксиду. Як розпізнати ці речовини?
5. За допомогою рівнянь реакцій проілюструйте хімічні властивості калій гідроксиду й кальцій гідроксиду (вапняної води).
6. Складіть рівняння реакцій, що відповідають таким схемам пеоетвооень:
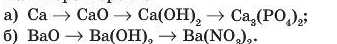
7. У трьох пробірках містяться розчини хлоридної кислоти, натрій гідроксиду й кальцій гідроксиду (вапняної води). Запропонуйте найкоротший спосіб їхнього визначення.
8. Скільки молекул H2SO1 і скільки молів натрій гідроксиду мають вступити в реакцію між собою, щоб утворилася сіль Na2SO1 масою 4,26 г?
9. Скільки структурних частинок кальцій оксиду й молекул води утворюється під час розкладання 107 г кальцій гідроксиду?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:47, Переглядів: 2430