§ 54. Витискувальний ряд металів. Заходи безпеки під час роботи з кислотами
У цьому параграфі ви дізнаєтеся:
• що таке витискувальний ряд металів;
• які метали спроможні, а які не спроможні витискувати водень із кислот;
• яких заходів безпеки потрібно дотримуватися під час роботи з кислотами.
Спостереження за реакціями взаємодії металів із кислотами доводять, що їх перебіг залежить від реакційної спроможності металів. Ця властивість визначає місце їх розташування у витиску вально му ряду металів': чим далі в послідовності розміщено метал, тим менша його хімічна активність.
1 Витискувальний ряд, або ряд активності, ще називають рядом стандартних електродних потенціалів металів.
У скороченому варіанті витискувальний ряд металів можна подати у такий спосіб:

Як бачимо, на початку ряду активності розташовані дуже хімічно активні метали (Li, К, Na), а закінчується ряд благородними, тобто хімічно пасивними (неактивними) металами (Pt, Au). Кожний наступний метал є менш активним за попередній і тому менш енергійно витискує водень із розчинів кислот.
Результати проведеного досліду (див. § 53) відповідають розташуванню магнію, цинку, заліза та міді у витискуваль-ному ряду металів: магній, що найенергійпіше реагує з кислотами, стоїть попереду багатьох інших металів, а мідь, яка не витискує водень із кислот, у витискувальному ряду розташована серед мало хімічно активних металів (справа від водню).
Взаємодія кислот з металами характерна лише для розчинних у воді кислот. Кислоти, що не розчиняються у воді, наприклад метасилікатна H2SiO3, з металами не реагують. Нерозчинні кислоти не змінюють і забарвлення індикаторів — лакмусу й метилового оранжевого.
Заходи безпеки під час роботи з кислотами. Працюючи з кислотами, у першу чергу із сульфатною H2SO1 і нітратною HNO3, необхідно дотримуватися певних заходів безпеки.
Так, зокрема, сульфатна кислота спричиняє тяжкі опіки шкіри, руйнує одяг.

Микола Миколайович Бекетов (1827-1911)
У 1855-1887 роках професор Харківського університету, основоположник нової галузі науки — фізичної хімії. У 1863 році склав витискувальний ряд металів.
З розчинами кислот слід поводитись обережно!
У пробірки покладіть видані вам шматочки металів (цинк, залізо, олово, алюміній, мідь) і прилийте до них приблизно по 1 см3 розчину хлоридної кислоти. Що спостерігаєте? У яких пробірках відбувається виділення газу? Що це за газ? Чи всі метали витискують водень із кислоти? Напишіть рівняння реакцій, що відбулися. Поясніть ваші спостереження, спираючись на положення металів у ряду активності.
Для допитливих
Кислоти широко розповсюджені в природі. Зі свого життєвого досвіду ви знаєте, що багатьом харчовим продуктам притаманний кислий смак. Лимони кислі
Унаслідок розчинення аміаку у воді утворюється його гідрат складу NHs-H2O, який має слаболужне середовище. У разі запису рівнянь реакцій гідрату аміаку, наприклад із розчином кислоти, позначення H2O часто опускають.
через те, що їхні плоди містять лимонну кислоту, яблука — яблучну, листя щавлю — щавлеву, а скисле молоко і квашена капуста — молочну кислоту (рис. 63). Вона міститься також у бджолиній отруті та жалких волосках кропиви.
Найуживаніша в нашому побуті кислота — оцтова CH3COOH. Вона була відома людині ще з давнини. Оцтова кислота утворюється в процесі прокисання виноградного соку або вина. У прадавні часи люди помітили, що прокисле виио розчиняє речовини, нерозчинні у воді. Римський письменник і вчений Пліній (23-79 н. е.) розповідав, що єгипетська цариця Клеопатра розчиняла в прокислому вині перлини.

Рис. 63. Кислоти в природі: щавлева — у щавлі (а), мурашина — у кропиві (б), лимонна — у лимоні (в), яблучна — в яблуці (г), молочна — у прокислому молоці ( мурахи виробляють для захисту від ворогів мурашину кисло
Приклади розв’язування задач
Приклад 1. За допомогою яких реакцій обміну можна одержати нітратну, хлоридну, силікатну й ортофос-фатну кислоти?
Розв'язання
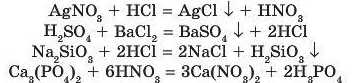
Приклад 2. Як добути кислоти: а) із двох газуватих речовин із подальшим розчиненням у воді; б) із двох твердих речовин; в) із двох рідких речовин; г) із твердої і газуватої речовини з подальшим розчиненням у воді?
Розв’язання

0I. Де в ряду активності розташовані дуже хімічно активні метали: а) на початку ряду; б) у середині ряду; в) у кінці ряду?
°2. Для яких кислот: а) розчинних у воді; б) нерозчинних у воді характерна взаємодія з металами?
°3. Де у витискувальному ряду розташовані благородні метали Ag, Pt, Au: а) до водню; б) після водшо?
4. Яких заходів безпеки необхідно дотримуватися під час роботи з розчинами кислот?
5. Якими є рівняння реакцій взаємодії: а) магнію з хло-ридпою кислотою; б) алюмінію з розведеною сульфатною кислотою? Скільки молекул водню H2 утвориться, якщо в кожній із цих реакцій прореагувало 14,6 г кислоти?
6. Хлоридна кислота реагує з металами:

Напишіть рівняння можливих реакцій. 7. Здійсніть такі перетворення:
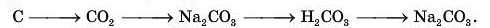
Напишіть рівняння реакцій.
*8. Зразок алюмінію обробили хлоридною кислотою, число молекул якої 5,418 -IO23. Обчисліть: а) кількість речовини алюмінію, який розчинився; б) об’єм (н. у.) водню, який виділився.
9. З ряда' металів Pt, Cr, Fe, Mg, Hg, Cd, Al, Zn, Cu, Mn, Ni, Ag виберіть ті, що витискують водень із хлоридної та розведеної сульфатної кислот.
10. Швидкість перебігу реакції:
магній + кислота = сіль + водень T зросте, якщо використати: а) дуже розведену хлоридну кислоту; б) концентровану хлоридну кислоту; в) холодний розчин кислоти; г) підігрітий розчин кислоти.
11. Укажіть, які з наведених попарно взятих речовин будуть взаємодіяти за звичайних умов:
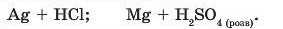
Складіть рівняння можливих реакцій.
* 12. Визначте, який об’єм водню (и. у.) можна одержати внаслідок дії розведеної сульфатної кислоти на шматочок сплаву цинку з міддю масою 10 г, якщо маса цинку в ньому складає 6,5 г.
Експериментуємо вдома
Уперше індикатори виявив англійський хімік Р. Бойль (1663). Випадково він капнув сульфатною кислотою на пелюстку фіалки та побачив, що колір пелюстки змінився. Так учений установив, що кислоти змінюють колір забарвлених рослинних соків.
Дослідіть дію розчину різних речовин на забарвлені соки, наприклад на сік столових буряків. Візьміть коренеплід, натріть на дрібній терці й вичавіть через марлю сік. Можна скористатися для цього сокодавильницею. Розподіліть вичавлений сік по чотирьох склянках. Прилийте в одну склянку трохи столового оцту, у другу вичавте кілька крапель лимонного соку з лимона. До вмісту третьої склянки додайте трішки розчину питної соди NaHCO3, а в четверту прилийте трохи мильного розчину (наприклад, розведеного засобу для миття посуду). Що спостерігаєте? Запишіть спостереження й висновки в зошит.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:15, Переглядів: 7298