§ 52. Хімічні властивості кислот: взаємодія із солями
У цьому параграфі ви дізнаєтеся:
• у чому полягають особливості взаємодії кислот із солями;
• які реакції називають реакціями обміну.
Взаємодія кислот із солями. У результаті цієї реакції утворюються нова кислота і нова сіль.
Реакції кислот із солями мають такі особливості:
а) кислота, яка утворилася внаслідок реакції, має бути більш леткою, ніж кислота, що вступила в реакцію:
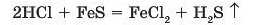
Сульфідна кислота H2S — більш летка, ніж хлоридна кислота HCL З розчину продуктів реакції виділяється газ — дигідро-ген сульфід (сірководень) H2S;
б) реакція між кислотою та сіллю відбувається, якщо при цьому утворюється слабка кислота, тобто така, яка легко розкладається па кислотний оксид і воду:
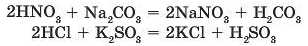
Карбонатна кислота H2CO3 є слабкішою порівняно з нітратною кислотою HNO3, вона розкладається з виділенням карбон(ІУ) оксиду, а сульфітна кислота є слабкішою за хлорид-ну, вона повністю рокладається в момент утворення з виділенням сульфур(ІУ) оксиду:
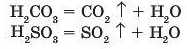
в) якщо утворена кислота ані летка, ані слабка, тоді утворена сіль має бути важкорозчинною, тобто випадати в осад на дно посудини:
HaSO1 + BaCl, = BaSO1 4- + 2НС1
Zl Z 1
Реакції обміну. У процесі ознайомлення з взаємодією кислот з оксидами металічних елементів, основами та солями ви спостерігали, як із двох складних речовин, які взаємодіють, у результаті перебігу реакції утворюються дві інші складні речовини.
Наприклад:
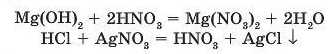
З рівняння реакції нітратної кислоти з основою Mg(OH)2 видно, що дві складні речовини — основа та кислота — обмінюються своїми складовими: атоми металічного елемента замінюються на атоми Гідрогену, гідроксильні групи — на кислотні залишки.
У реакції кислоти із сіллю атоми металічного елемента обмінюються на атоми Гідрогену в молекулі вихідної кислоти.
Реакції між двома складними речовинами, під час перебігу яких ці речовини обмінюються між собою своїми складовими, унаслідок чого утворюються дві нові складні речовини, називають реакціями обміну.
У загальному вигляді рівняння реакції обміну можна записати в такий спосіб:
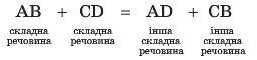
і Приклади розв’язування задач
Приклад I. На суміш магпій сульфіту з магній оксидом масою 43 г подіяли хлоридною кислотою. Унаслідок реакції отримали газувату речовину складу SO2 об’ємом 8,96 дм3 (н. у.). Якими були маси солі й оксиду в суміші?

Приклад 2. Визначте масу Карбону в кальцій карбонаті, якщо внаслідок його взаємодії з нітратною кислотою утворився газу-ватий оксид масою 8,8 г.

Запитання та завдання
1. У чому полягають особливості взаємодії кислот із солями: а) безоксигеиових кислот; б) оксигено-вмісііих кислот? Наведіть приклади.
0 2. Дайте визначення реакціям обміну. Наведіть приклади.
3. У якому випадку внаслідок реакції обміну між кислотою та сіллю з двох вихідних речовин утворюються три інші складні речовини? Наведіть приклади.
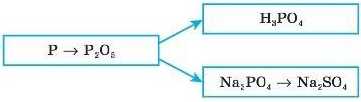
4. Якими рівняннями реакцій можна передати такі перетворення:
* 5. Якими рівняннями можна подати перебіг реакцій обміну:
а) між ортофосфатною кислотою й аргептум(І) нітратом AgNO3;
б) між сульфатною кислотою й барій хлоридом BaCl2;
в) між нітратною кислотою й калій карбонатом K2CO3;
г) між хлоридною кислотою й натрій сульфідом Na2S?
6. Дано такі речовини: кальцій гідроксид, хлоридна кислота, сульфур(УІ) оксид, кальцій оксид. Які з них реагуватимуть між собою? Напишіть рівняння відповідних реакцій.
* 7. Обчисліть, скільки молів сульфатної кислоти потрібно
взяти для нейтралізації розчину, що містить 28 г калій гідроксиду.
8. На суміш кальцій оксиду з кальцій карбонатом масою 3 г подіяли хлоридиою кислотою. Унаслідок цього виділився газ об’ємом 0,56 дм3 (н. у.). Якою була маса солі в суміші?
9. Яка маса сульфатної кислоти вступила в реакцію з барій хлоридом, якщо внаслідок її перебігу виділився осад кількістю речовини 0,0601 моль?
10. Визначте масу Нітрогену в аргентум нітраті, якщо внаслідок його взаємодії з хлоридиою кислотою утворився осад масою 28,7 г.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:13, Переглядів: 2153