§ 51. Хімічні властивості кислот: взаємодія з основними оксидами й основами
У цьому параграфі ви дізнаєтеся:
• як розчини кислот змінюють забарвлення індикаторів;
• які сполуки утворюються в результаті взаємодії кислот з основними оксидами й основами;
• що таке реакція нейтралізації.
Дія кислот на індикатори. Один зі способів, за допомогою яких відрізняють розчини кислот від речовин інших класів сполук, є зміна кольору індикаторів. Ви вже знаєте, як змінюється колір у разі додавання до кислот лакмусу. Ще один з індикаторів — метилоранж у розчинах кислот змінює своє забарвлення з помаранчевого на червоне.
Лабораторний дослід 4
Дія водних розчинів кислот на індикатори
З розчинами кислот необхідно поводитись обережно!
Налийте у дві пробірки приблизно по 2 см3 розчину розведеної сульфатної кислоти.
В одну з них додайте 2-3 краплі розчину нейтрального лакмусу, а в другу — стільки ж розчину метилового оранжевого.
Що спостерігаєте? Якого кольору набувають індикатори?
Взаємодія кислот з основними оксидами й основами. Дослідимо загальні хімічні властивості кислот за схемою, якою ви вже користувалися, коли вивчали клас оксидів. Перевіримо, чи реагують кислоти з основними оксидами та основами. Після цього з’ясуємо, чи відбуваються хімічні перетворення за участі кислот і металів, кислот і солей (схема 9).
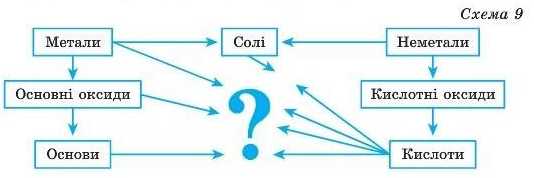
З реакціями кислот і основних оксидів ви вже ознайомилися, коли вивчали хімічні властивості основних оксидів:
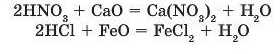
Таку хімічну властивість кислот використовують у виробництві деяких солей, а також для очищення поверхні металу, найчастіше заліза, від плівки його оксидів перед тим, як покрити її фарбою чи іншим металом.
Реакції основних оксидів (тобто оксидів, утворених тільки металічними елементами) з кислотами можна узагальнити такою схемою:
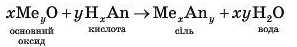
Продуктами цих реакцій є розчинна сіль і вода.
Перевіримо на досліді, чи взаємодіють кислоти з основами.
У хімічний стакан із хлоридиою кислотою HCl додамо 2-3 краплі фіолетового лакмусу. У кислому середовищі такий лакмус забарвлюється в червоний колір. Потім будемо краплинами додавати розчин калій гідроксиду KOH із бюретки — градуйованої скляної трубки, призначеної для обережного приливання одного розчину до іншого (рис. 61). На нижньому кінці бюретки є кран або зажим. Із крана можна приливати розчин малими порціями, щоб точно встановити закінчення реакції в стакані.
Якщо розчину KOH ми додали стільки, що вся кислота HCl вступила в реакцію, то забарвлення лакмусу змінюється на фіолетове. Це означає, що в стакані відсутні як кислота, так і луг, бо вони повністю прореагували одне з одним. Якщо

додати в стакан ще краплю лугу, то йому не буде із чим реагувати. Тоді лакмус забарвиться в синій колір і покаже надлишкову кількість лугу в розчині. Отже, оскільки розчин став фіолетовим, то середовище нейтральне. Випаривши розчин, ми отримаємо сіль КС1.
Взаємодію між калій гідроксидом і хлоридиою кислотою передають рівнянням
KOH + HCl = KCl + H2O Реакцію між кислотою та основою, у результаті якої утворюється сіль і вода, називають реакцією нейтралізації (від латинського neutralis, що означає «той, що не належить пі тому, ні іншому»).
Ця реакція характерна для кислот та основ: усі кислоти реагують з розчинами основ, а всі основи — з розчинами кислот. Продуктом реакції нейтралізації є сіль і вода, наприклад:
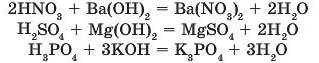
У загальному вигляді реакцію нейтралізації можна записати у такий спосіб:
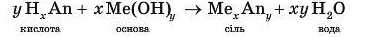
І Запитання та завдання
° 1. У який колір у кислому середовищі забарвлюються індикатори: а) фенолфталеїн; б) лакмус; в) метилоранж?
0 2. Як називають реакцію взаємодії кислот з основами?
3. Які продукти реакції утворюються внаслідок взаємодії кислот з: а) основними оксидами; б) основами? Якими узагальненими рівняннями реакцій це можна подати?
4. Складіть шість рівнянь реакцій, які характеризують хімічні властивості сульфатної кислоти з точки зору її взаємодії з основними оксидами та основами.
5. З якими з перелічених речовин прореагує хлоридиа кислота: CO2, КОН, P2O5, Ba(OH)2, Fe(OH)2, CuO, SO2? Складіть рівняння реакцій, які відбуваються.
* 6. Якими рівняннями реакцій можна передати взаємодію ні
тратної кислоти з: а) ферум(ІІ) оксидом; б) барій оксидом;
в) натрій оксидом? Яка кількість речовини оксиду прореагує та яка маса води утвориться в кожному випадку, якщо в реакцію з оксидами вступало по 9,03-1023 молекул кислоти?
* 7. Оксид магнію масою 20 г обробили розчином, що містить
40 г хлоридпої кислоти. Обчисліть кількість речовини обох продуктів реакції, які при цьому утворилися.
8. Якщо у вас є такі речовини: сульфур(УІ) оксид SO3, калій гідроксид, нітратна кислота, барій оксид, то якими рівняннями реакцій можна передати можливі взаємодії цих неорганічних речовин, якщо їх узяти попарно?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:13, Переглядів: 2695