§ 46. Загальні способи добування оксидів
У цьому параграфі ви дізнаєтеся:
• як можна отримати оксиди.
Способи добування оксидів базуються на їхніх хімічних властивостях.
1. Оксиди утворюються внаслідок взаємодії простих речовин із киснем O2- Деякі із цих речовин вступають у реакцію з киснем O2 під час нагрівання, наприклад:
2Са + O2 = 2СаО (за температури, вищої за 300 cC),
N2 + O2 = 2N0 (за температури, вищої за 2000 °С),
2Zn + 0., = 2ZnO (за температури, вищої за 225 С), 4А1(порошок) + ЗО., = 2А1203 (згоряння па повітрі), а деякі навіть на холоді:
4Rb + O2 -> 2Rb,0
Цей спосіб добування оксидів ще називають прямим.
2. У результаті взаємодії складних речовин із киснем O2, як правило за високих температур, утворюються переважно оксиди тих елементів, з яких складається вихідна речовина, наприклад:
2H2S + 302 = 2Н20 + 2S02 (за температури 300 °С)
3. Оксиди можна отримати і в результаті розкладання окси-геиовмісних сполук.
Під час нагрівання деяких переважно нерозчинних основ утворюються оксид відповідного металічного елемента й вода:
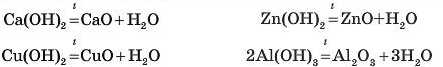
Такий спосіб одержання оксидів називають посереднім.
У результаті нагрівання деяких кислот теж можливе утворення оксиду відповідного иеметалічного елемента й води:
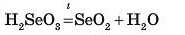
Подібний тип хімічних реакцій часто називають реакціями дегідратації, тобто реакціями, протилежними реакціям гідратації — приєднання води.
Деякі солі розкладаються під час нагрівання па оксиди відповідних металічного і иеметалічного елементів:
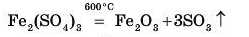
Нагрівання деяких оксидів супроводжується утворенням оксиду, у якому елемент виявляє нижчу валентність, і виділенням кисню:

В інших випадках, навпаки, нагрівання оксидів деяких елементів на повітрі спричиняє до утворення оксиду, у якому елемент виявляє вищу валентність:
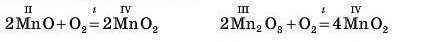
і Запитання та завдання
° 1. Який спосіб одержання оксидів називають прямим? Наведіть приклади.
2. Оксиди можуть утворюватися внаслідок взаємодії
з киснем: а) тільки простих речовин; б) тільки складних речовин; в) як простих, так і складних речовин. Наведіть приклади.
3. Який спосіб одержання оксидів відносять до реакцій дегідратації? Наведіть приклади.
4. Чи можна одержати оксиди: а) термічним розкладанням солей оксигеновмісиих кислот; б) термічним розкладанням оксидів елементів із високою або найвищою валентністю; в) окисиеиням оксидів із низькою валентністю до оксидів, у яких елемент виявляє більш високу валентність? Наведіть приклади.
5. Яка маса оксиду утвориться внаслідок дегідратації алюміній гідроксиду, узятого кількістю речовини 0,04 моль?
6. Які оксиди утворяться внаслідок розкладання карбонатної кислоти? Який об’єм (н.у.) займає газ, якщо розклалося 1,505* IO23 молекул кислоти?
7. На оксиди яких елементів розкладається за високої температури магній карбонат? Яку масу цієї речовини потрібно взяти, щоб одержати 16 г оксиду, який за звичайних умов є твердою речовиною? Який об’єм (н.у.) займатиме оксид другого елемента?
8. Чому дорівнює масова частка (%) пеметалічиого елемента в оксиді, який утворюється внаслідок дегідратації мета-силікатної кислоти HnSiO0?
«с о
9. У результаті згоряння арсину AsH3, як і в разі згоряння H2S, утворюються оксид пеметалічиого елемента (As2O3) і вода. У якому мольному співвідношенні утворяться арсен(ІН) оксид і сульфур(ІУ) оксид у разі згоряння AsH3 і H2S, якщо в обох випадках в реакцію вступило 0,6 моль кисню?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:11, Переглядів: 1150